Расчет количества вещества, прореагировавшего в результате электрохимической реакции, по законам Фарадея. Расчет равновесных электродных потенциалов для металлических и газовых электродов по уравнению Нернста.
Пример 1. Законы Фарадея. Расчет массы вещества, полученного в электрохимическом процессе.
Какова масса меди, выделившейся на электроде при прохождении через электрохимическую систему количества электричества, равного 2 F и выходе меди по току, равном единице (100 %)?
Решение. Количественно электрохимические превращения веществ подчиняются двум законам Фарадея:
1) масса или количество вещества, претерпевшего превращение на электроде при протекании постоянного тока, прямо пропорционально количеству прошедшего электричества;
2) при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны молярным массам их эквивалентов. Из этого следует, что для электрохимического превращения 1 моль эквивалента вещества требуется одинаковое количество электричества F, называемое числом Фарадея. F = 96500Кл или F =26,8 А.час.
Оба эти закона можно объединить следующими выражениями:
расчет массы вещества:  ,
,
где МЭ – молярнаямасса эквивалента вещества, г/моль,  ;
;
Q – количество электричества, израсходованное на превращение вещества, Кл.
 , где I – сила тока, А; t – время процесса, с.
, где I – сила тока, А; t – время процесса, с.
Согласно закону Фарадея при прохождении количества электричества, равного 2 F выделится 2 моль эквивалента меди, что составляет:
m Сu= M эСu·2=(63,57/2)г/моль · 2 моль=63,57 г.
Пример 2. Законы Фарадея. Расчет объема газа, полученного в электрохимическом процессе. Выход по току.
Определите выход по току, выделенного на электроде при нормальных условиях водорода, если объем его составил 112 л при прохождении через электрод 1000 А·ч.
Решение. Закон Фарадея (см. Пример 1) для расчета объема газообразных веществ:  ,
,
где VЭ – объем моль-эквивалента газа, л/моль;  ;
;
Q – количество электричества, израсходованное на превращение вещества, Кл,
 , где I – сила тока, А; t – время процесса, с.
, где I – сила тока, А; t – время процесса, с.
При нормальных условиях (н.у.) 1 моль любого газа занимает объем
 = 22,4 л, поэтому объем 1 моля эквивалента водорода при н.у. составляет
= 22,4 л, поэтому объем 1 моля эквивалента водорода при н.у. составляет  л/моль; для кислорода
л/моль; для кислорода  л/моль.
л/моль.
При протекании на электроде нескольких реакций на превращение каждого конкретного вещества j тратится определенная доля количества электричества Вj, называемая выходом вещества j по току, и определяемая выражением:  .
.
Объем моль эквивалента водорода при н.у. составляет
V0Э,H2 =22,4/2 = 11,2 л. Для выделения такого объема водорода требуется количество электричества, равное 1 F, или 26,8 А·ч.
Следовательно, для выделения 112 л требуется количество электричества
 F . (V0H2/V0Э,H2) =26,8.(112/ 11,2)=268 А·ч.
F . (V0H2/V0Э,H2) =26,8.(112/ 11,2)=268 А·ч.
Найдем выход по току водорода:
B H2 =  =268 А·ч/1000 А·ч=0,27 (или 27%).
=268 А·ч/1000 А·ч=0,27 (или 27%).
Пример 3. Расчет равновесного потенциала металлического электрода.
Вычислите равновесный потенциал никелевого электрода, если при температуре 298 К никелевая пластинка опущена в раствор соли NiSO4 с концентрацией 0,01 моль/л.
Решение. Для металлических электродов потенциалопределяющей является реакция:
M(р)n+ + n 
 M(тв).
M(тв).
Уравнение Нернста для расчета равновесного потенциала металлического электрода, поскольку активность твердой фазы принимают равной единице, имеет вид:
 .
.
Для 298 К, переходя к десятичному логарифму, имеем:
 .
.
Для никелевого электродов потенциалопределяющей является реакция:
Ni2+(р) + 2 
 Ni (тв).
Ni (тв).
Равновесный потенциал Eр Ni2+/Ni при 298 К рассчитываем по уравнению Нернста:
Eр Ni2+/Ni = E 0 Ni2+/Ni + (0,059/2)·lg a Ni2+.
Значения стандартных потенциалов электродов в водных растворах при 298 К, определенные по водородной шкале представлены в Приложении 6 [1]. E 0 Ni2+/Ni = -0,25 В.
Активность ионов Ni2+ находим по формуле:
а Ni2+ =γNi2+· c Ni2+, где γNi2+ - коэффициент активности, который определяется ионной силой раствора I:
I =0,5(c Ni2+· z 2 Ni2+ + c so42- · z 2 so42- )=0,5(0,01·22+0,01·(-2)2)=0,04.
Коэффициент активности при данном значении ионной силы равен γNi2+=0,895. Следовательно, а Ni2+=0,895·0,01моль/л=8,95·10-3моль/л.
После подстановки значений стандартного потенциала E 0 Ni2+/Ni и активности а Ni2+ в уравнение для расчета потенциала получаем:
Eр Ni2+/Ni = -0,25 + (0,059/2)·lg 8,95 ·10-3=-0,31 B.
Пример 4. Расчет равновесного потенциала водородного электрода.
Рассчитайте значение равновесного потенциала водородного электрода при  =5·10-7, pH=2, T =298 К.
=5·10-7, pH=2, T =298 К.
Решение. Для водородного электрода потенциалопределяющая реакция
2Н+ + 2 
 Н2,
Н2,
уравнение Нернста запишем в виде:
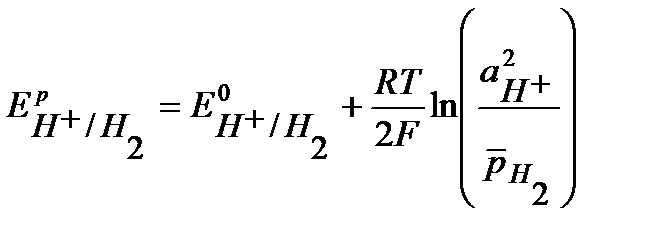 .
.
Поскольку стандартный потенциал  , (см. Приложение 6[1]), а водородный показатель
, (см. Приложение 6[1]), а водородный показатель  , то при 298 К имеем выражение для расчета равновесного водородного потенциала:
, то при 298 К имеем выражение для расчета равновесного водородного потенциала:
 .
.
Равновесный потенциал водородного электрода находим по этому выражению уравнения Нернста:
Eр H+/H2 = -0,0295· lg  –0,059pH= -0,0295·lg 5·10-7-0,059·2= -0,068 В.
–0,059pH= -0,0295·lg 5·10-7-0,059·2= -0,068 В.
Пример 5. Расчет равновесного потенциала кислородного электрода.
Рассчитайте значение равновесного потенциала кислородного электрода при  =5, pH=2, T =298 К.
=5, pH=2, T =298 К.
Решение. Газовый кислородный электрод представляет собой Pt – электрод, на котором осуществляется потенциалопределяющая реакция:
О2 + 4  + 2Н2О
+ 2Н2О  4ОН- .
4ОН- .
Уравнение Нернста для такого электрода:
 .
.
Стандартный потенциал кислородного электрода  = 0,401В (при
= 0,401В (при  и
и  моль/л) по водородной шкале (Приложение 6 [1]).
моль/л) по водородной шкале (Приложение 6 [1]).  При 298 К, учитывая что
При 298 К, учитывая что 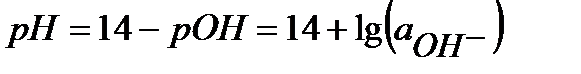 , имеем удобное выражение для расчета потенциала кислородного электрода:
, имеем удобное выражение для расчета потенциала кислородного электрода:
 .
.
Воспользуемся этим выражением уравнения Нернста для расчета равновесного потенциала  кислородного электрода:
кислородного электрода:
Eр О2/ОH- =1,23 +0,0147· lg  –0,059pH =1,23+0,0147· lg 5–0,059.2=1,12 В.
–0,059pH =1,23+0,0147· lg 5–0,059.2=1,12 В.