Написание уравнений электродных процессов, токообразующей реакции в гальваническом элементе. Расчет энергии Гиббса токообразующей реакции, расчет электродвижущей силы гальванических элементов. Построение поляризационных кривых электродов в гальваническом элементе.
Пример 1. Работагальванического элемента при стандартном состоянии. Расчет стандартной ЭДС гальванического элемента. Поляризационные кривые.
Рассмотрите работу серебряно-цинкового гальванического элемента. Напишите катодные и анодные процессы, рассчитайте стандартную ЭДС элемента при 298 К двумя способами.
Решение. Выпишем из таблицы приложения 6 [1] значения стандартных электродных потенциалов цинка и серебра:
 В,
В,  В.
В.
Т.к.  , электроны будут переходить от цинкового электрода к серебряному. Тогда в заданном ГЭ серебряный электрод – катод, цинковый электрод – анод.
, электроны будут переходить от цинкового электрода к серебряному. Тогда в заданном ГЭ серебряный электрод – катод, цинковый электрод – анод.
Электродные реакции для серебряно-цинкового элемента записываются следующим образом:


Суммируя анодную и катодную реакции, получаем уравнение токообразующей реакции (ТОР):
Zn + 2Ag+ → 2Ag + Zn2+.
Рассчитаем стандартную ЭДС гальванического элемента Е 0Э .
1 способ: рассчитаем  этого ГЭ, как разность стандартных потенциалов катода и анода по уравнению:
этого ГЭ, как разность стандартных потенциалов катода и анода по уравнению:
 = 0,799 – (– 0,763) = 1,562 В.
= 0,799 – (– 0,763) = 1,562 В.
2 способ: Электродвижущая сила элемента связана с энергией Гиббса ТОР  уравнением:
уравнением:
 ,
,
где п - количество моль-эквивалентов вещества.
В общем случае, для ТОР реакции:
bB + dD → lL + mM,
протекающей в ГЭ при стандартных состояниях веществ при Т = 298 К, энергия Гиббса  рассчитывается по табличным значениям по уравнению:
рассчитывается по табличным значениям по уравнению:
 .
.
В соответствии с этим рассчитываем стандартную энергию Гиббса ТОР  нашего ГЭ:
нашего ГЭ:

(Дж);
Рассчитаем стандартную ЭДС по известной энергии Гиббса:  B.
B.
Значения  , рассчитанные первым и вторым способами, практически равны между собой.
, рассчитанные первым и вторым способами, практически равны между собой.
В работающем ГЭ при прохождении тока I напряжение U меньше ЭДС из-за явления поляризации катода (D EК) и анода (D ЕА) и омического падения напряжения на сопротивлении r1 в проводниках с электронной проводимостью (проводниках первого рода) и на сопротивлении r2 в электролите (проводнике второго рода)
 .
.
Поляризацией называется изменение потенциала электрода при прохождении электрического тока:  , где Ei - потенциал электрода под током; Еp – равновесный потенциал электрода.
, где Ei - потенциал электрода под током; Еp – равновесный потенциал электрода.
В гальваническом элементе при прохождении электрического тока потенциал анода становится более положительным, а потенциал катода – более отрицательным, что приводит к уменьшению напряжения U.
Ход поляризационных кривых ГЭ: 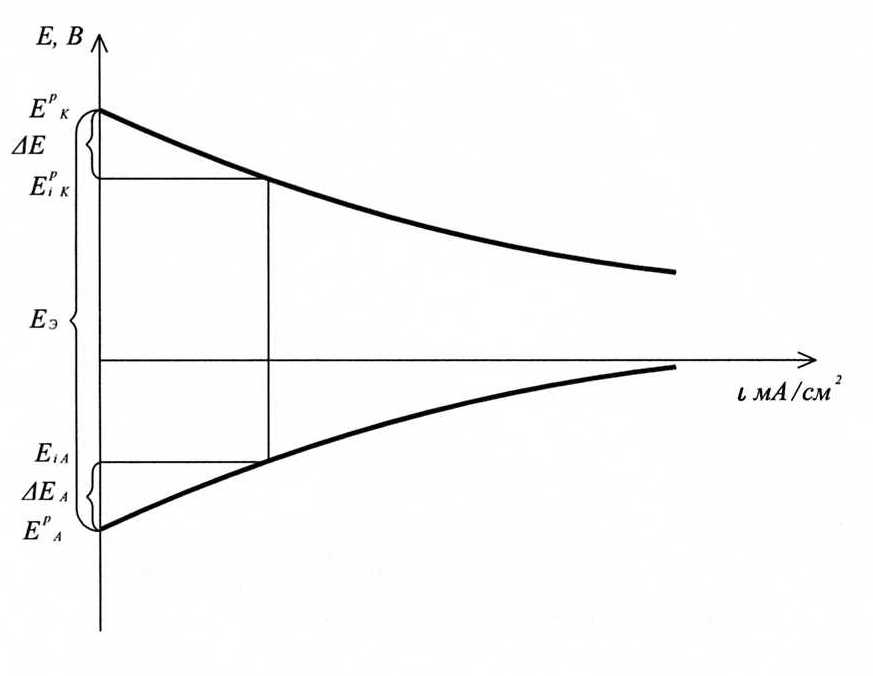 .
.
Пример 2. Расчет ЭДСгальванического элемента при нестандартном состоянии.
Рассчитать ЭДС серебряно – цинкового ГЭ при Т = 298 К, если активность Zn2+ и Ag+ равны по 0,01 моль/л.
Решение. Процессы, протекающие в ГЭ, и стандартная ЭДС элемента те же, что в примере 1.
Равновесные потенциалы электродов рассчитываем по уравнению Нернста для металлических электродов при 298 К
 :
:
 B.
B.
 B.
B.
ЭДС заданного ГЭ:
 B.
B.
Пример 3. Расчет величины максимально вырабатываемой электроэнергии в гальваническом элементе.
Рассчитайте величину максимальной электроэнергии, которая может быть выработана серебряно – цинковым ГЭ при уменьшении массы анода на 1 г в результате протекания электрохимической реакции при условиях заданных в примере 1.
Решение. Количество электричества Q, прошедшего через электродную поверхность, рассчитывается из объединенного закона Фарадея:
 ,
,
где F – число Фарадея F = 96500Кл или F =26,8 А.час;
М – молярнаямасса вещества, г/моль;
n – число электронов, принимающих участие в электрохимическом процессе;
Q – количество электричества, израсходованное на превращение вещества, Кл;
 , где I – сила тока, А; t – время процесса, с.
, где I – сила тока, А; t – время процесса, с.
Анодом в заданном ГЭ является цинковый электрод, молярная масса
М Zn = 65,4 г/моль.
Рассчитаем 
 .
.
Максимально вырабатываемая электроэнергия (электрическая работа W элmax ) в гальваническом элементе связана с ЭДС о энергией Гиббса ТОР:
 , Дж/моль. В то же время
, Дж/моль. В то же время  .
.
Тогда  или W эл = 1,23 Вт. ч.
или W эл = 1,23 Вт. ч.
Пример 4. Расчет ЭДСгальванического элемента при нестандартном состоянии. Способы увеличения ЭДС.
Рассчитайте ЭДС цинк-хлорного ГЭ, если  , и
, и  моль/л при Т = 298 К. Предложите способы увеличения
моль/л при Т = 298 К. Предложите способы увеличения  ГЭ.
ГЭ.
Решение. Согласно табл. приложения 6 [1] значения стандартных электродных потенциалов:
 =1,359 В,
=1,359 В,  В.
В.
Рассчитаем значения равновесных электродных потенциалов для соответствующих электродов по уравнению Нернста.
Для потенциалопределяющей реакции Zn2+ + 2 
 Zn:
Zn:
 В.
В.
Для потенциалопределяющей реакции Cl2(газ) + 2 
 2Cl–(р)
2Cl–(р)
 В.
В.
Так как  >
> 
 , то цинковый электрод – анод, хлорный электрод – катод. Уравнения электродных реакций и ТОР:
, то цинковый электрод – анод, хлорный электрод – катод. Уравнения электродных реакций и ТОР:
А-: Zn – 2  → Zn2+
→ Zn2+
К+: Cl2 + 2  → 2Cl–
→ 2Cl–
ТОР: Zn + Cl2 → Zn2+ + 2Cl–
Вычислим значение ЭДС ГЭ:  В.
В.
В общем случае, для ТОР реакции:
bB + dD → lL + mM
ЭДС гальванического элемента для ТОР при активности ионов отличных от 1 моль/л можно рассчитать из выражения:
 ,
,
где аВ, аD, аL, aM, – активности веществ; b, d, l, m – стехиометрические коэффициенты ТОР. Для твердых веществ активности принимают равными единице, для газов используют относительное парциальное давление.
ЭДС цинк-хлорного гальванического элемента при 298 К:
 .
.
Увеличить ЭДС данного ГЭ можно, если:
– увеличить температуру;
– уменьшить активность ионов Zn2+;
– уменьшить активность ионов Cl– ;
– увеличить парциальное давление Cl2.
Пример 5. Концентрационный гальванический элемент.
Рассчитайте ЭДС концентрационного ГЭ:
H2,Pt | НCl || СН3СООН| H2,Pt, работающего при одинаковых давлениях  и одинаковых концентрациях водных растворов кислот c = 0,1 моль/л.
и одинаковых концентрациях водных растворов кислот c = 0,1 моль/л.
Решение. Для кислой среды уравнения электродных реакций в концентрационном элементе:
А -: H2 → 2H+ + 2 
К+: 2H+ + 2  → H2
→ H2
Величина равновесного потенциала этих электродов определяется по уравнению
 , при
, при  .
.
Рассчитаем активность ионов водорода  :
:
а) в растворе уксусной кислоты: СН3СООН  СН3СООН– + H+,
СН3СООН– + H+,
т.к. уксусная кислота является слабым электролитом, то коэффициент активности γ  и
и  =
=  ;
;
 = αс0 , где степень диссоциации
= αс0 , где степень диссоциации  и тогда
и тогда

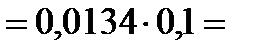
 моль/л, следовательно
моль/л, следовательно  В.
В.
б) в растворе соляной кислоты: HCl → H+ + Cl–, т.к. НСl является сильным электролитом, то сначала рассчитываем ионную силу раствора:
 ,
,
затем по таблице находим коэффициент активности γ  и тогда:
и тогда:
 моль/л и
моль/л и  В.
В.
Т.к.  , рассчитанный для соляной кислоты более положительный, чем для уксусной, то катодом будет электрод погруженный в раствор соляной кислоты, анодом - электрод погруженный в раствор уксусной кислоты.
, рассчитанный для соляной кислоты более положительный, чем для уксусной, то катодом будет электрод погруженный в раствор соляной кислоты, анодом - электрод погруженный в раствор уксусной кислоты.
 В.
В.