Пример 1. Анодное покрытие для защиты металла от электрохимической коррозии.
Предложите анодное покрытие для защиты стального (Fe) изделия от электрохимической коррозии в кислородсодержащей среде при 298 К, рН = 7,  . Напишите уравнения коррозионных процессов при нарушении целостности покрытия.
. Напишите уравнения коррозионных процессов при нарушении целостности покрытия.
Решение. В качестве анодного покрытия для Fe можно использовать металлы с более отрицательным значением потенциала, (например, Zn, Cr, Al и др.).
Например, выберем хром, стандартный потенциал  В, более отрицательный, чем
В, более отрицательный, чем 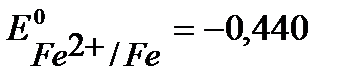 В. (см. Приложение 6 [1]).
В. (см. Приложение 6 [1]).
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
 В,
В,
 В.
В.
т.к. 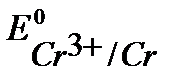 <
<  , то при нарушении целостности хромового покрытия на железном изделии роль анода будет выполнять хром.
, то при нарушении целостности хромового покрытия на железном изделии роль анода будет выполнять хром.
Так как  <
<  ,
,  , то в данной среде термодинамически возможна коррозия хрома с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна коррозия хрома с кислородной и водородной деполяризацией:
A- : Cr → Cr3+ + 3e
K+ : O2 + 2H2O + 4e → 4OH-
2H2O + 2e → H2 + 2OH-
В нейтральной среде хром отличается высокой коррозионной стойкостью вследствие склонности к пассивации. Продукты коррозии хрома (Cr2O3 , Cr(OH)3 и др.) образуют на поверхности металла плотные труднорастворимые оксидно-солевые пленки, обладающие защитными свойствами, которые затрудняют контакт металла с окислителем и тормозят дальнейший процесс коррозии. Поэтому, хотя термодинамически коррозия возможна, стальное изделие c хромовым покрытием реально не разрушается под действием коррозии.
Пример 2. Катодное покрытие для защиты металла от электрохимической коррозии.
Предложите катодное покрытие для защиты стального (Fe) изделия от электрохимической коррозии в кислородсодержащей среде при
298 К, рН = 8 и  . Напишите уравнения процессов в коррозионном гальваническом элементе при нарушении целостности покрытия.
. Напишите уравнения процессов в коррозионном гальваническом элементе при нарушении целостности покрытия.
Решение. В качестве катодного покрытия для Fe можно использовать металлы с более положительным значением потенциала, (например, Ni, Cu, Ag и др.).
Например, выберем медь, стандартный потенциал  В, более положительный, чем
В, более положительный, чем  , (см. Приложение 6 [1]).
, (см. Приложение 6 [1]).
Так как  <
<  , то при нарушении целостности медного покрытия на железном изделии роль анода будет выполнять железо.
, то при нарушении целостности медного покрытия на железном изделии роль анода будет выполнять железо.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
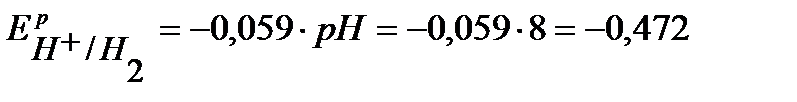 В,
В,
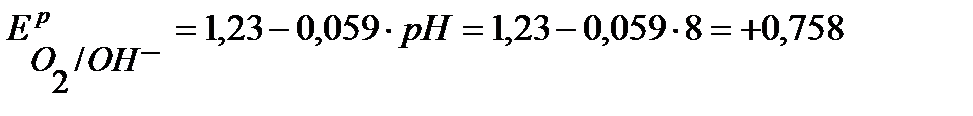 В.
В.
Так как  <
<  <
<  , то в данной среде термодинамически возможна коррозия железа с кислородной деполяризацией и невозможна коррозия с выделением водорода. Уравнения коррозионных процессов:
, то в данной среде термодинамически возможна коррозия железа с кислородной деполяризацией и невозможна коррозия с выделением водорода. Уравнения коррозионных процессов:
A- : Fe → Fe2+ + 2e
K+ : O2 + 2H2O + 4e → 4OH--
Стальное изделие при этом будет разрушаться.
Пример 3. Электрохимическая коррозия сплава. Расчет массы разрушенного металла.
Напишите уравнения электрохимической коррозии сплаваSn-Zn при рН=5 и 298 К. Сколько и какого металла прокорродировало, если в процессе коррозии поглотилось 56 мл кислорода и выделилось 22,4 мл водорода? Определите, чему равен коррозионный ток, если продолжительность коррозии 20 мин. Относительные парциальные давления газов считать равными: 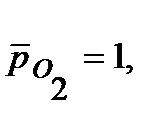
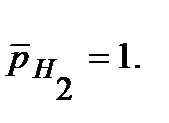
Решение. Стандартные потенциалы металлов (см. Приложение 6 [1]):
 B,
B,  B,
B,
т.к.  <
< 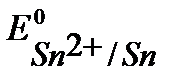 то в заданной гальванической паре анодом будет цинк, а катодом – олово.
то в заданной гальванической паре анодом будет цинк, а катодом – олово.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
 В,
В,
 В.
В.
Так как  <
<  ,
,  , то в данной среде термодинамически возможна электрохимическая коррозия цинка с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна электрохимическая коррозия цинка с кислородной и водородной деполяризацией:
A- : Zn → Zn2+ + 2e
K+ : O2 + 2H2O + 4e → 4OH-
2H2O + 2e → H2 + 2OH-.
В соответствии с заданием определим количество моль-эквивалентов поглотившегося кислорода и выделившегося водорода (условия считаем нормальными,  л/моль,
л/моль, 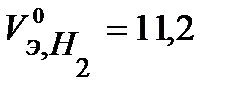 л/моль):
л/моль):
 моль-экв,
моль-экв,
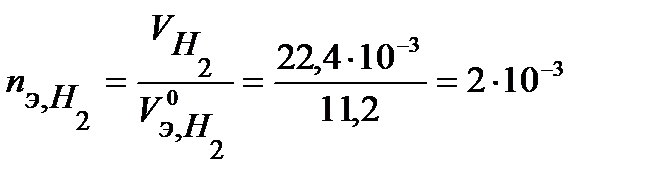 моль-экв.
моль-экв.
Таким образом, на катоде претерпело изменение 1,2.10-2 моль-эквивалентов вещества. По закону эквивалентов такое же количество вещества растворится на аноде:  . Масса прокорродировавшего цинка (с учетом массы моля эквивалента цинка
. Масса прокорродировавшего цинка (с учетом массы моля эквивалента цинка  г/моль) равна:
г/моль) равна:
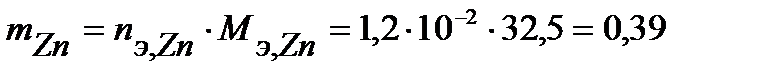 г.
г.
Величина коррозионного тока определяется по закону Фарадея:
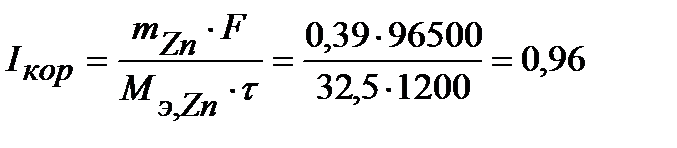 А.
А.
Пример 4. Протекторная защита металла от электрохимической коррозии.
Выберите протектор для защиты стальной конструкции (Fe) в кислой среде (рН=4) на воздухе при 298 К. Напишите уравнения процессов коррозии. Рассчитайте, как изменится масса протектора, если за некоторое время в процессе коррозии поглотилось 112 мл кислорода и выделилось 112 мл водорода.
Решение. При протекторной защите к металлическому изделию непосредственно или через металлический проводник подсоединяются металл или сплав с более отрицательным значением потенциала, чем потенциал защищаемого изделия. Для железа ( В) в качестве анодного протектора можно использовать магний (
В) в качестве анодного протектора можно использовать магний ( В), цинк
В), цинк
( В), алюминий (
В), алюминий (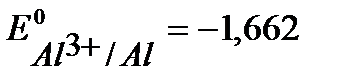 В), (см. Приложение 6[1]).
В), (см. Приложение 6[1]).
При контакте с окислителем металл протектора растворяется, а защищаемое изделие не разрушается. Например, выберем магний. Так как 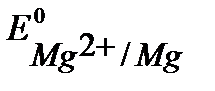 <
<  , то в паре с железом магний будет анодом.
, то в паре с железом магний будет анодом.
Согласно уравнению Нернста равновесные потенциалы вероятных окислителей (Н+ и О2) равны:
 В,
В,


 +0,990В.
+0,990В.
При расчете  учтено процентное содержание кислорода в воздухе - 21%, т.е.
учтено процентное содержание кислорода в воздухе - 21%, т.е. 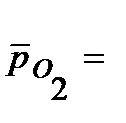 0,21.
0,21.
Так как  <
<  ,
,  , то в данной среде термодинамически возможна электрохимическая коррозия магниевого протектора с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна электрохимическая коррозия магниевого протектора с кислородной и водородной деполяризацией:
A- : Мg → Мg2+ + 2e
K+ : O2 + 4H+ + 4e → 2H2О
2H+ + 2e → H2.
В соответствии с заданием определим количество моль-эквивалентов поглотившегося кислорода и выделившегося водорода (условия считаем нормальными,  л/моль,
л/моль, 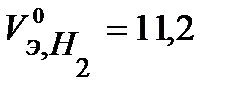 л/моль):
л/моль):
 моль-экв,
моль-экв,
 моль-экв.
моль-экв.
Таким образом, на катоде претерпело изменение 3.10-2 моль-эквивалентов окислителя. По закону эквивалентов такое же количество протекторного материала растворилось на аноде:  моль-экв. Масса растворившегося протектора (с учетом молярной массы эквивалента магния
моль-экв. Масса растворившегося протектора (с учетом молярной массы эквивалента магния  г/моль) равна:
г/моль) равна:
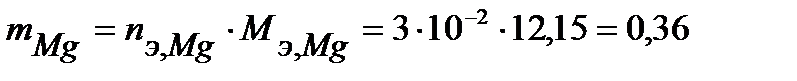 г.
г.