Ответ на вопрос 4. Изохорный процесс, Изобарный процесс, Адиабатный процесс, Политропный процесс, процесс преобразования, удельная теплота парообразования, теплопроводность.
Изохорный процесс – это процесс, протекающий при постоянном объеме. Линия AB, изображающая процесс графически, называется изохорой. Связь между параметрами газа при изохорном процессе определяется законом Шарля. При изохорном процессе все подводимое тепло расходуется на изменение внутренней энергии газа. Газ не изменяет своего объема, и работа расширения равна нулю
Изобарный процесс – это процесс, протекающий при постоянном давлении. Линия CD, изображающая процесс графически, называется изобарой. Связь между параметрами начального Vc, Tc и конечного состояния VD, TD выражается законом Гей – Люссака. При изобарном процессе газ изменяет свой объем и совершает работу расширения A:
A = p (VD – VC).
Изотермический процесс – это процесс, протекающий при постоянной температуре. Линия EF, изображающая процесс графически, называется изотермой. Связь между параметрами состояния при изотермическом процессе определяется законом Бойля – Мариотта. При изотермическом процессе газ изменяет свой объем и совершает работу А:

Индексы E и F характеризуют точку, состояния газа в которой данный параметр описывает.
Адиабатный процесс – это процесс, происходящий без подвода или отвода тепла. Линия LN, изображающая процесс графически, называется адиабатой. Связь между параметрами состояния выражается уравнением адиабатного процесса
pVK = const,
где p – давление газа, Па;
V – объем газа, м3/кг;
K – показатель адиабаты.
Из уравнения адиабатного процесса могут быть выведены следующие формулы, связывающие параметры состояния в точках L и N:

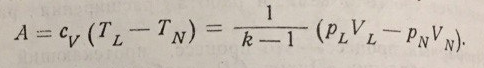
При адиабатном процессе газ совершает работу
Политропный процесс – это процесс, подчиняющийся уравнению pVn =const, где n – показатель политропы (величина постоянная для данного процесса). Все остальные процессы вытекают из политропного. При n=0 процесс изобарный, при n=1 – изотермический, при n  ∞ - изохорный, при n=k – адиабата. Связь между параметрами газа при политропном процессе выражается уравнениями:
∞ - изохорный, при n=k – адиабата. Связь между параметрами газа при политропном процессе выражается уравнениями:

Процесс преобразования – это процесс перехода вещества, как правило, из жидкой фазы в газообразную. Различают понятия “испарения” и “кипения”. Испарение – переход вещества из жидкого в парообразное состояние, происходящий на поверхности жидкости. Кипение – интенсивный переход жидкости в пар во всем объеме жидкости, сопровождающийся быстрым образованием и увеличением размеров пузырьков газа. Температура, при которой жидкость кипит, называется температурой кипения.
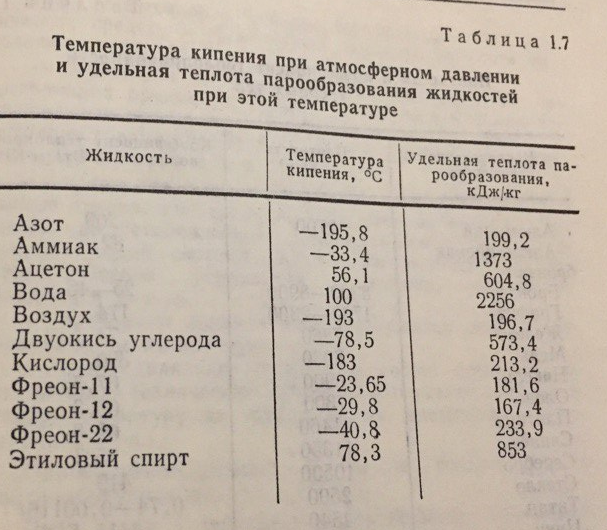
Удельная теплота парообразования – это количество энергии, необходимой для превращения в пар 1кг жидкости без изменения его температуры. В табл.1.7 приведены величины температуры кипения при атмосферном давлении и удельной теплоты парообразования наиболее распространенных на корабле жидкостей.
Конец лекции №1
Теплопроводность – процесс распространения тепловой энергии при непосредственном соприкосновении тел с разной температурой. При теплопроводности само вещество не перемещается. Изменяется только скорость теплового движения частиц. Для плоской пластины толщиной х, разделяющей области с разными температурами t1 и t2, количество переданного тепла q через поверхность площадью S за время t равно
q =  (t1 – t2 ) tS,
(t1 – t2 ) tS,
где λ – коэффициент теплопроводности зависящий от свойств материала пластины, Вт/ (м×К).
В табл. 1.8 приведены величины плотности и коэффициентов теплопроводности твердых тел, а в приложении 3 – величины плотности, коэффициентов теплопроводности и предельной температуры применения теплоизоляционных материалов.

Ответ на вопрос 5. Диаграмма Молье
Для практических целей наиболее важно рассчитать время охлаждения груза с помощью имеющегося на борту судна оборудования. Поскольку возможности судовой установки по сжижению газов во многом определяют время стоянки судна в порту, знание этих возможностей позволит заранее планировать стояночное время, избегать ненужных простоев, а значит и претензий к судну.
Диаграмма Молье. которая приводится ниже (рис. 62), рассчитана только для пропана, но метод ее использования для всех газов одинаков(рис. 63).
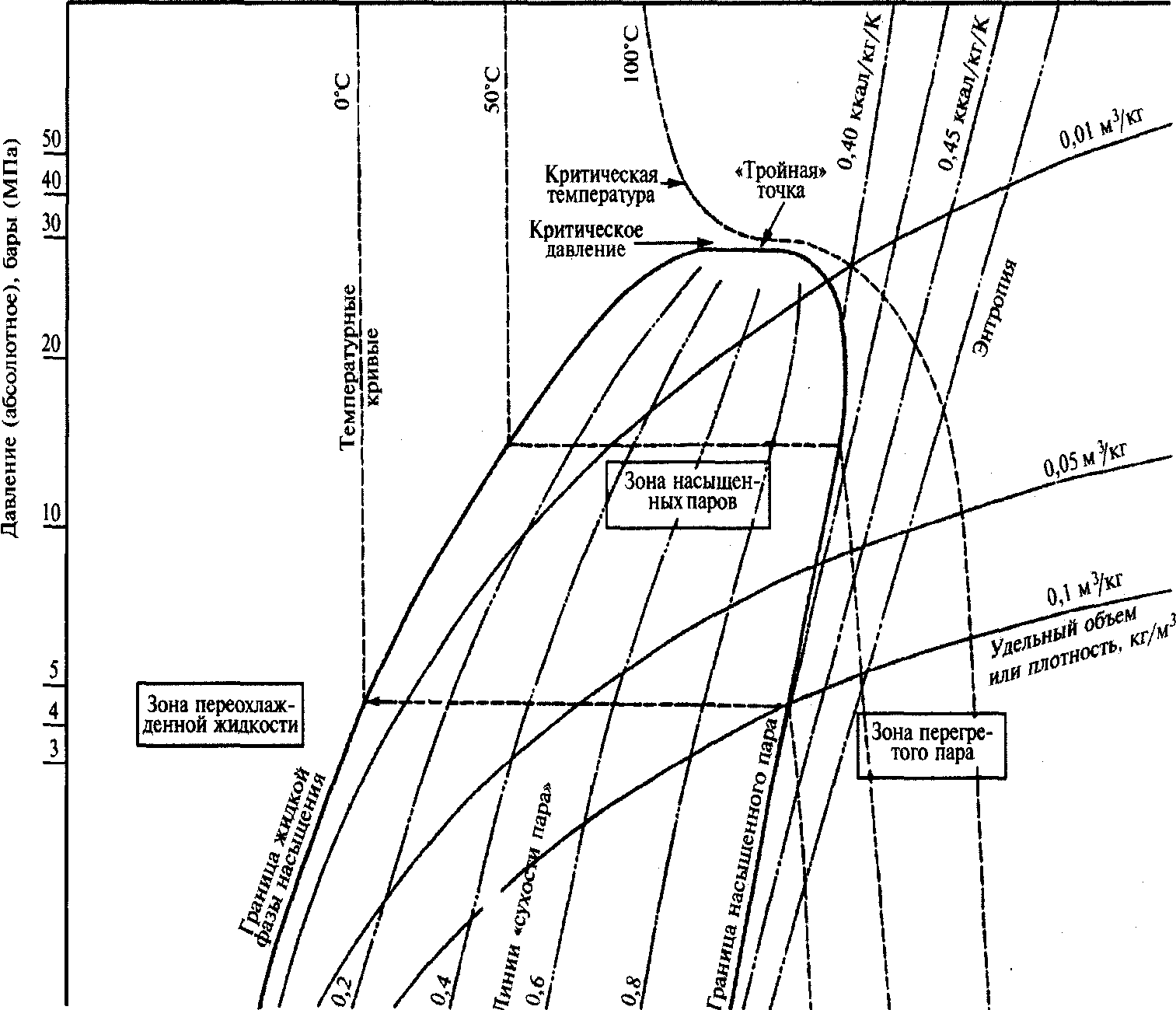
На диаграмме Молье используется логарифмическая шкала абсолютного давления (р log) — на вертикальной оси, на горизонтальной оси h— натуральная шкала удельной энтальпии (см. рис. 62, 63). Давление— в МПа, 0,1 МПа = 1 бар, поэтому в дальнейшем будем использовать бары. Удельная энтальпия измеряется кДж/кг. В дальнейшем при решении практических задач будем постоянно использовать диаграмму Молье (но только ее схематичное изображение с тем, чтобы понять физику тепловых процессов, происходящих с грузом).
На диаграмме можно легко заметить своего рода «сачок», образованный кривыми. Границы этого «сачка» очерчивают пограничные кривые смены агрегатных состояний сжиженного газа, которые отражают переход жидкости в насыщенный пар. Все, что находится слева от «сачка», относится к переохлажденной жидкости, а все то, что справа от «сачка», — к перегретому пару (см. рис 63).
Пространство между этими кривыми представляет собой различные состояния смеси насыщенных паров пропана и жидкости, отражающие процесс фазового перехода. На ряде примеров рассмотрим практическое использование* диаграммы Молье.
Пример 1:
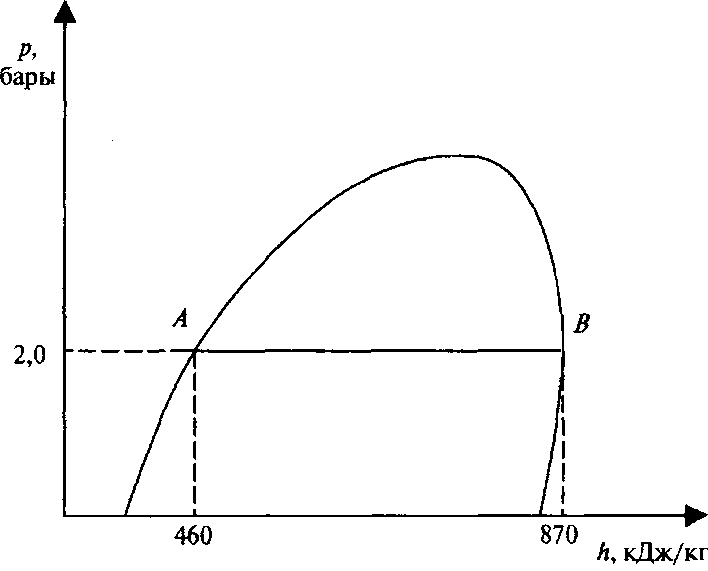
Проведите линию, соответствующую давлению в 2 бара (0,2 МРа), через участок диаграммы, отражающий смену фаз (рис. 64).
Для этого определим энтальпию для 1 кг кипящего пропана при абсолютном давлении 2 бара.
Как уже отмечалось выше, кипящий жидкий пропан характеризуется левой кривой диаграммы. В нашем случае это будет точка А, Проведя из точки А вертикальную линию к шкале h энтальпии, определим значение энтальпии, которое составит 460 кДж/кг. Это означает, что каждый килограмм пропана в данном состоянии (в точке кипения при давлении 2 бара) обладает энергией в 460 кДж. Следовательно, 10 кг пропана будут обладать энтальпией 460 кДж. Далее определим величину энтальпии для сухого насыщенного пара пропана при том же давлении (2 бара). Для этого проведем вертикальную линию из точки В до пересечения со шкалой h энтальпии. В результате найдем, что максимальное значение энтальпии для 1кг пропана в фазе насыщенных паров составит 870 кДж. Внутри диаграммы
* Для расчетов используются данные из термодинамических таблиц пропана (см. Приложения).
Рис. 64. К примеру 1 Рис. 65. К примеру 2

 Удельная энтальпия, кДж/кг (ккал/кг)
Удельная энтальпия, кДж/кг (ккал/кг)
Рис. 63. Основные кривые диаграммы Молье
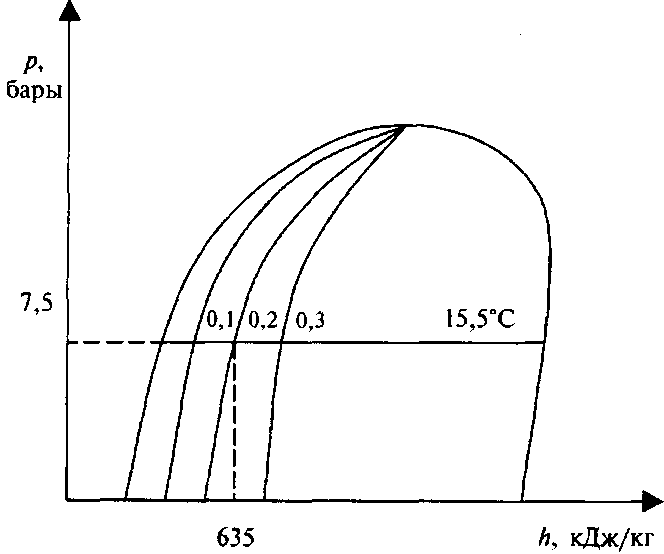
(рис. 65) линии, направленные из точки критического состояния газа вниз, отображают количество частей газа и жидкости в фазе перехода. Иными словами, 0,1 означает, что смесь содержит 1 часть паров газа и 9 частей жидкости. В точке пересечения давления насыщенных паров и этих кривых определим состав смеси (ее сухость или влажность). Температура перехода постоянна в течение всего процесса конденсации или парообразования. Если пропан находится в замкнутой системе (в грузовом танке), в ней присутствуют и жидкая и газообразная фазы груза. Можно определить температуру жидкости, зная давление паров, а давление паров — по температуре жидкости. Давление и температура связаны между собой, если жидкость и пар находятся в равновесном состоянии в замкнутой системе. Заметим, что кривые температуры, расположенные в левой части диаграммы, опускаются почти вертикально вниз, пересекают фазу парообразования в горизонтальном направлении и в правой части диаграммы опять опускаются вниз почти вертикально.
П р и м е р 2:
Предположим, что есть 1 кг пропана в стадии смены фаз (часть пропана жидкость, а часть — пар). Давление насыщенных паров составляет 7,5 бар, а энтальпия смеси (пар—жидкость) равна 635 кДж/кг.
Необходимо определить, какая часть пропана находится в жидкой фазе, а какая в газообразной. Отложим на диаграмме прежде всего известные величины: давление паров (7,5 бар) и энтальпию (635 кДж/кг). Далее определим точку пересечения давления и энтальпии — она лежит на кривой, которая обозначена 0,2. А это, в свою очередь, означает, что мы имеем пропан в стадии кипения, причем 2 (20%) части пропана находятся в газообразном состоянии, а 8 (80%) находятся в жидком.
Также можно определить манометрическое давление жидкости в танке, температура которой 60° F, или 15,5° С (для перевода температуры будем использовать таблицу термодинамических характеристик пропана из Приложения).
При этом необходимо помнить, что это давление меньше давления насыщенных паров (абсолютного давления) на величину атмосферного давления, равного 1,013 мбара. В дальнейшем для упрощения расчетов мы будем использовать значение атмосферного давления, равное 1 бару. В нашем случае давление насыщенных паров, или абсолютное давление, равно 7,5 бара, поэтому манометрическое давление в танке составит 6,5 бара.
Рис. 66. К примеру 3
Ранее уже упоминалось, что жидкость и пары в равновесном состоянии находятся в замкнутой системе при одной и той же температуре. Это верно, однако на практике можно заметить, что пары, находящиеся в верхней части танка (в куполе), имеют температуру значительно выше, чем температура жидкости. Это обусловлено нагревом танка. Однако такой нагрев не влияет на давление в танке, которое соответствует температуре жидкости (точнее, температуре на поверхности жидкости). Пары непосредственно над поверхностью жидкости имеют ту же самую температуру, что и сама жидкость на поверхности, где как раз и происходит смена фаз вещества.
Как видно из рис. 62—65, на диаграмме Молье кривые плотности направлены из левого нижнего угла диаграммы «сачка» в правый верхний угол. Значение плотности на диаграмме может быть дано в Ib/ft3. Для пересчета в СИ используется переводной коэффициент 16,02 (1,0 Ib/ft3 = 16,02 кг/м3).
Пример 3: В этом примере будем использовать кривые плотности. Требуется определить плотность перегретого пара пропана при абсолютном давлении 0,95 бара и температуре 49° С (120° F). 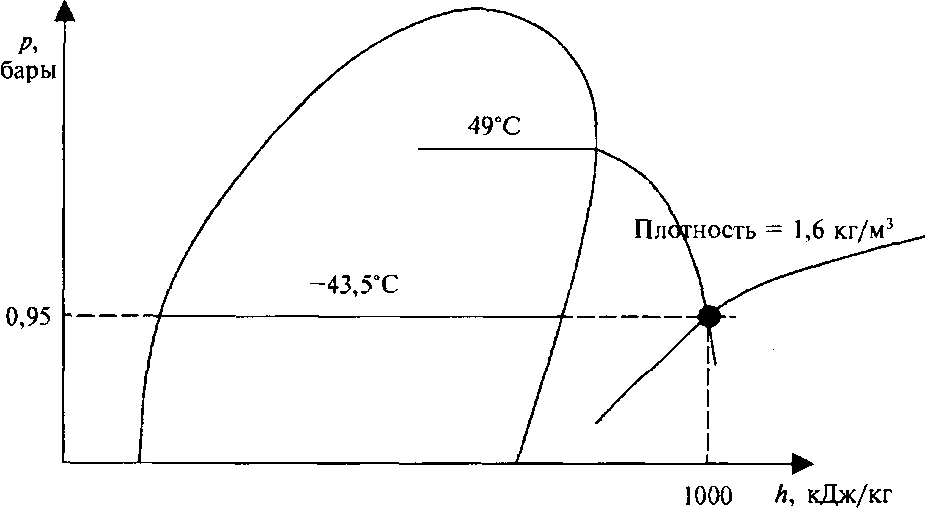 Также определим удельную энтальпию этих паров.
Также определим удельную энтальпию этих паров.
Решение примера видно из рис 66.
В наших примерах используются термодинамические характеристики одного газа — пропана.
В подобных расчетах для любого газа меняться будут только абсолютные величины термодинамических параметров, принцип же остается тот же самый для всех газов. В дальнейшем для упрощения, большей точности расчетов и сокращения времени будем использовать таблицы термодинамических свойств газов.
Практически вся информация, заложенная в диаграмму Молье, приведена в табличной форме.
С  помощью таблиц можно найти значения параметров груза, но трудно. Рис. 67. К примеру 4 представить себе, как идет процесс.. охлаждения, если не использовать хотя бы схематичное отображение диаграммы p—h.
помощью таблиц можно найти значения параметров груза, но трудно. Рис. 67. К примеру 4 представить себе, как идет процесс.. охлаждения, если не использовать хотя бы схематичное отображение диаграммы p—h.
Пример 4: В грузовом танке при температуре -20' С находится пропан. Необходимо определить как можно точнее давление газа в танке при данной температуре. Далее необходимо определить плотность и энтальпию паров и жидкости, а также разность'энтальпии между жидкостью и парами. Пары над поверхностью жидкости находятся в состоянии насыщения при той же температуре, что и сама жидкость. Атмосферное давление составляет 980 млбар. Необходимо построить упрощенную диаграмму Молье и отобразить все параметры на ней.
Используя таблицу (см. Приложение 1), определяем давление насыщенных паров пропана. Абсолютное давление паров пропана при температуре -20° С равно 2,44526 бар. Давление в танке будет равно: