Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.

I. Общие с другими кислотами
1. Диссоциация:
R-COOH ↔ RCOO- + H+
-Сила кислот уменьшается в ряду:
H-COOH > CH3-COOH > CH3-CH2-COOH
2. Взаимодействие с активными металлами:
2R-COOH + 2Na → 2R-COONa + H2↑
3. Взаимодействие с основными оксидами и основаниями:
2R-COOH + CaO → (R-COO)2Ca + H2O
4. Взаимодействие уксусной кислоты с раствором щелочи
R-COOH + NaOH → R-COONa + H2O
5. Взаимодействие с солями слабых кислот:
R-COOH + NaHCO3 → R-COONa + H2O + CO2↑
-Соли карбоновых кислот разлагаются сильными минеральными кислотами:
R-COONa + HСl → NaCl + R-COOH
-В водных растворах гидролизуются:
R-COONa + H2O ↔ R-COOH + NaOH
6. Образование сложных эфиров со спиртами:

II. Специфические свойства
1. Образование функциональных производных R-CO-X
(свойства гидроксильной группы)
Получение хлорангидридов:
R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
2. Образование амидов
CH3COOH + NH3→CH3COONH4 t˚C→ CH3CONH2 + H2O

Вместо карбоновых кислот чаще используют их галогенангидриды:
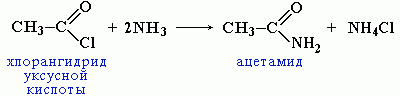
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
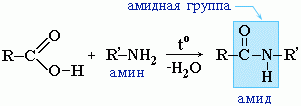
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп - пептидных связей
3. Реакции замещения с галогенами
(свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты):

|
5. Реакции декарбоксилирования солей карбоновых кислот (получение алканов):
R-COONa + NaOH t → Na2CO3 + R-H (алкан)
6. Окисление в атмосфере кислорода:
R-COOH + O2 → CO2 + H2O
Особенности муравьиной кислоты H-COOH:
Даёт реакцию «Серебряного зеркала»:
H-COOH + 2[Ag(NH3)2]OH → 2Ag↓ + (NH4)2CO3 + 2NH3 + H2O
Окисление хлором:
H-COOH + Cl2 → CO2 + 2HCl
Вступает в реакцию с гидроксидом меди(II):
H-COOH + 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3H2
Разлагается при нагревании:
HCOOH t,H2SO4→ CO↑ + H2O
Непредельные карбоновые кислоты способны к реакциям присоединения:
СН2=СН-СООН + Н2 → СН3-СН2-СООН
СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН
СН2=СН-СООН + HCl → СН2Сl-СН2-СООН
СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН
Две последние реакции протекают против правила Марковникова.
Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации.
Получение карбоновых кислот
I. В промышленности
1. Выделяют из природных продуктов (жиров, восков, эфирных и растительных масел)
2. Окисление алканов:
2CH4 + 3O2 t,kat → 2HCOOH + 2H2O
метан муравьиная кислота
2CH3-CH2-CH2-CH3 + 5O2 t,kat,p → 4CH3COOH + 2H2O
н-бутан уксусная кислота
3. Окисление алкенов:
CH2=CH2 + O2 t,kat → CH3COOH
этилен
СH3-CH=CH2 + 4[O] t,kat → CH3COOH + HCOOH
пропен уксусная кислота муравьиная кислота
4. Окисление гомологов бензола (получение бензойной кислоты):
C6H5-CnH2n+1 + 3n[O] KMnO4,H+→ C6H5-COOH + (n-1)CO2 + nH2O
5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
толуол бензойная кислота
5. Получение муравьиной кислоты:
1 стадия: CO + NaOH t,p → HCOONa
формиат натрия – соль
2 стадия: HCOONa + H2SO4 → HCOOH + NaHSO4
6. Получение уксусной кислоты:
CH3OH + CO t,p → CH3COOH
Метанол
II. В лаборатории
1. Гидролиз сложных эфиров:
OH-
R-COOR1 + H2O ↔ RCOOH + R1-OH
H+
2. Из солей карбоновых кислот:
R-COONa + HCl → R-COOH + NaCl
3. Растворением ангидридов карбоновых кислот в воде:
(R-CO)2O + H2O → 2 R-COOH
4. Щелочной гидролиз галоген производных карбоновых кислот:
R- C = O + NaOH → R-COOH + NaCl
│
Cl