Строение и реакционные способности карбоновых кислот
План:
1.Строение карбоксильной группы.
2. Классификация карбоновых кислот.
3. Изомерия.
4. Номенклатура.
5. Физические свойства предельных одноосновных кислот.
6. Химические свойства карбоновых кислот.
7. Получение карбоновых кислот.
8. Применение.
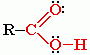
1. Карбоновые кислоты – это кислородсодержащие органически вещества, молекулы которых содержат одну или несколько карбоксильных групп (-СOOH), соединённых с углеродным радикалом или водородным атомом.
Карбоксильная группа сочетает в себе две функциональные группы – карбонил >C=O и гидроксил -OH, взаимно влияющие друг на друга:
Классификация
А) По числу карбоксильных групп в молекуле
| Название | Примеры |
| 1) Одноосновные |
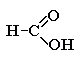 Метановая, муравьиная кислота
Метановая, муравьиная кислота
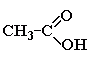 Этановая, уксусная кислота
Этановая, уксусная кислота
|
| 2) Двухосновные | HOOC – COOH
Щавелевая кислота

|
| 3) Многоосновные |

|
Б) По природе углеводородного радикала
| Название | Примеры |
| 1) Предельные (насыщенные) | HCOOH Метановая, муравьиная кислота CH3COOH Этановая, уксусная кислота |
| 2) Непредельные | Акриловая кислота СН2=СНСООН Кротоновая кислота СН3–СН=СН–СООН Олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН Линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН Линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН |
| 3) Ароматические | С6Н5СООН – бензойная кислота НООС–С6Н4–СООН Пара-терефталевая кислота |
Изомерия
I. Структурная
А) Изомерия углеродного скелета (начиная с C4)
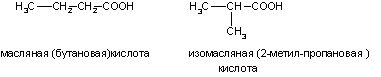
Б) Межклассовая со сложными эфирами R- CO – O- R1 (начиная с C2)
Например: для С3Н6О2
CH3-CH2-COOH пропионовая кислота
СH3-CO-OCH3 метиловый эфир уксусной кислоты
II. Пространственная
А) Оптическая
Например:

Б) Цис- транс – изомерия для непредельных кислот
Пример:

Номенклатура.
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота. Чтобы указать положение заместителя (или радикала), нумерацию углеродной цепи начинают от атома углерода карбоксильной группы. Например, соединение с разветвленной углеродной цепью (CH3)2CH-CH2-COOH называется 3-метилбутановая кислота.
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
Для органических кислот широко используются также тривиальные названия, которые обычно отражают природный источник, где были впервые обнаружены эти соединения.
Некоторые одноосновные кислоты
| Формула | Название кислоты R-COOH | Название остатка RCOO- | |
| систематическое | тривиальное | ||
| HCOOH | метановая | муравьиная | формиат |
| CH3COOH | этановая | уксусная | ацетат |
| C2H5COOH | пропановая | пропионовая | пропионат |
| C3H7COOH | бутановая | масляная | бутират |
| C4H9COOH | пентановая | валерьяновая | валерат |
| C5H11COOH | гексановая | капроновая | капрат |
| C15H31COOH | гексадекановая | пальмитиновая | пальмитат |
| C17H35COOH | октадекановая | стеариновая | стеарат |
| C6H5COOH | бензолкарбоновая | бензойная | бензоат |
| CH2=СH-COOH | пропеновая | акриловая | акрилат |
Для многоосновных кислот применяют суффиксы -диовая, -триовая и т.д.
Например:
HOOC-COOH - этандиовая (щавелевая) кислота;
HOOC-CH2-COOH - пропандиовая (малоновая) кислота.
Физические свойства предельных одноосновных кислот
| Название | Формула кислоты | tпл. °C | tкип. °C | ρ г/см3 | |
| кислоты | |||||
| муравьиная | метановая | HCOOH | 8,3 | 100,5 | 1,22 |
| уксусная | этановая | CH3COOH | 16,8 | 1,05 | |
| пропионовая | пропановая | CH3CH2COOH | -21 | 0,99 | |
| масляная | бутановая | CH3(CH2)2COOH | -6 | 0,96 |
Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Средние представители этого гомологического ряда — вязкие, "маслообразные" жидкости; начиная с С10 — твердые вещества. С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей:

Безводная муравьиная кислота – бесцветная жидкость (т. кип. 101 °С), с острым запахом и жгучим вкусом, вызывающая ожоги на коже.Муравьиная кислота впервые была выделена в XVII веке из красных лесных муравьев. Содержится также в соке жгучей крапивы.
Этановая (уксусная) кислота имеет характерный "уксусный" запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 16,8 °С она замерзает, превращаясь в льдистое вещество, которое получило название "ледяная" уксусная кислота. Уксусная кислота широко распространена в природе – содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в зеленых листьях). Образуется при брожении, гниении, скисании вина, пива, содержится в кислом молоке и сыре. Впервые получена в конце XVIII века русским ученым Т. Е. Ловицем.
Бензойная кислота C6H5COOH - наиболее важный представитель ароматических кислот. Это кристаллическое вещество, температура плавления 122°C, легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире. Распространена в природе в растительном мире: в бальзамах, ладане, эфирных маслах. В животных организмах она содержится в продуктах распада белковых веществ.