составить конспект (не присылать), можно решить задачу.
1. Растворами называют гомогенные системы, состоящие из растворённого вещества в виде ионов, молекул, равномерно распределившихся по всему объёму растворителя.
Растворы:
1. Газообразные (воздух)
2. Жидкие
3. Твёрдые (сплавы металлов)
Наибольшее значение имеют жидкие. Растворитель - вода(чаще всего).
В воде могут растворяться газы, жидкости, твёрдые вещества.
Растворы характеризуются концентрацией - количество растворённого вещества в определённом количестве раствора или растворителя.
2. Виды концентраций: (по этим формулам расчёт)
1. массовая доля растворённого вещества 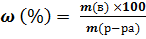 ;
;
2. молярная М = 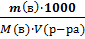 ;
;
3. нормальная N = 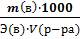 ;
;
Грамм – эквивалент Э (г-экв) – это количество вещества в граммах, эквивалентное одному атому или иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Э кислоты = 
Э основания = 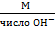
Э соли = 
4. моляльная Сm = 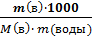
5. молярная доля компонента N1 = 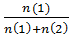 ; n(число молей)=
; n(число молей)= 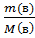 ; для раствора соли n(1) - количество соли, n(2) - количество воды.
; для раствора соли n(1) - количество соли, n(2) - количество воды.
3. Растворимость газов.
Многие газы растворяются в жидкостях. Растворимость зависит от природы вещества. Если между газом и растворителем нет взаимодействия, то обычно концентрация газа в растворе небольшая: водород, азот, кислород. Между молекулами аммиака и воды образуются водородные связи и в1л воды растворяется 700 объёмов аммиака.
Растворимость газа в значительной мере зависит от температуры. При повышении температуры растворимость их уменьшается. Длительное кипячение может удалить растворённые газы из жидкости.
Зависимость растворимости газов от давления определяется законом Генри " Растворимость данного газа в жидкости при постоянной температуре прямо пропорциональна его давлению над жидкостью "
При растворении жидкости в жидкости возможны три случая: а)неограниченная растворимость (вода и спирт, бензол и толуол); б)ограниченная растворимость (диэтиловый эфир и вода, анилин и вода); в)практическая нерастворимость (вода и масло). Полярные вещества растворимы в полярных, а неполярные в неполярных.
Процесс растворения твёрдых веществ в жидкостях состоит в разрушении кристаллической решётки и диффузии в объём растворителя. Между частицами вещества и молекулами воды образуются соединения- гидраты. На скорость растворения влияет площадь поверхности соприкосновения. Вторым фактором, влияющим на скорость растворения, является температура, повышение которой увеличивает скорость. Растворимость твёрдых тел зависит от природы растворителя и растворяемого вещества. Подобное растворяется в подобном.
Свойства растворов неэлектролитов. (конспект)
Диффузия. Сильно разбавленные растворы подчиняются законам идеальных газов. Если в концентрированный раствор сахара налить осторожно слой чистой воды, то через некоторое время концентрация сахара будет во всём объёме одинакова.
Самопроизвольное выравнивание концентрации растворённого вещества в растворе называется диффузией. Диффузия является самопроизвольным и необратимым процессом. Играет важную роль в жизнедеятельности организмов, в природных и технологических процессах.
Осмос. Если поместить концентрированный раствор сахара в опрокинутую воронку, закрытую снизу полупроницаемой мембраной (целлофаном),то опустив воронку с раствором сахара в стакан с водой, через некоторое время можно заметить повышение уровня жидкости в воронке. Молекулы воды перемещаются через полупроницаемую мембрану, а молекулы сахара нет. Односторонний переход растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией - осмос. Сила, обуславливающая осмос- осмотическое давление и определяется по формуле (закон Вант-Гоффа)
Pосм= С∙R∙T С - концентрация (моль/л) R - газовая пост. T - абсолютная температура.
Й закон Рауля.
При испарении жидкости над её поверхностью образуется пар. Происходят два противоположных процесса испарение ↔ конденсация. При равенстве скоростей испарения и конденсации устанавливается динамическое равновесие и насыщенный пар при данной температуре имеет постоянное давление. Так, при 200 С давление насыщенного пара воды равно 2,32 кПа, этанола 5,85 кПа. С повышением температуры давление насыщенного пара увеличивается. Если в растворителе растворить нелетучее вещество, то количество молекул растворителя, вылетающих с поверхности жидкости в единицу временит резко изменится (уменьшится). Равновесие между жидкостью и насыщенным паром устанавливается при более низком давлении по сравнению с давлением пара над одним растворителем.
Чем больше концентрация раствора, тем меньше давление насыщенного пара.
Закон Рауля Давление насыщенного пара над раствором (РА) равно давлению его над чистым растворителем (РА0), умноженному на молярную долю растворителя (NA)
РА=РА0 ∙ NA; NA = 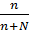 ; n- количество растворённого вещества N- количество растворителя. (моль)
; n- количество растворённого вещества N- количество растворителя. (моль)
Й закон Рауля.
В отличие от чистой жидкости раствор замерзает при более низкой температуре ниже 00С, а закипает при более высокой выше 1000С
Понижение ∆t замерзания и повышения ∆t кипения водных растворов прямо пропорционально моляльной концентрации растворённого вещества (количество молей вещества на 1000г растворителя).
Понижение температуры замерзания определяется:
∆t зам = Ккриос ∙ Сm (моляльная концентрация раствора - число молей растворённого вещества в 1000 г растворителя)
Сm = 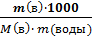 ; ∆t зам = Ккриос •
; ∆t зам = Ккриос • 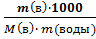
Ккриос - криоскопическая постоянная ( от греч. "криос" - холод) равна понижению температуры замерзания при растворении одного моля вещества в 1000 г растворителя. Ккриос Н2О= 1,86
Повышение температуры кипения определяется:
∆t кип = Кэбул ∙ Сm (моляльная концентрация раствора - число молей растворённого вещества в 1000 г растворителя)
∆t кип = Кэбул • 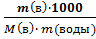
Кэбул - эбулископическая постоянная ( от лат. "эбулио" - вскипать) равна повышению температуры кипения при растворении одного моля вещества в 1000 г растворителя. Кэбул Н2О = 0, 513
На измерении понижения температуры замерзания или повышения температуры кипения основан один из методов определения относительной молекулярной массы.
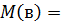 Кэбул •
Кэбул • 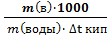 ;
; 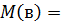 Ккриос •
Ккриос • 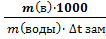 ;
;
решение задачи на концентрации.