Нормальные условия (НУ): Р0 = 760 мм.рт.ст. = 105 Па; Т0 = 273 К.
При НУ 1 моль любого идеального газа занимает один и тот же объём: V0 = 22.4 · 10 -3 м3.
1 моль любого вещества содержит одно и то же количество атомов или молекул, равное числу Авогадро NА = 6.02 · 10 23 1/моль.
1 моль вещества – это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в 12 граммах изотопа углерода 12, т. е. С12.
Число Лошмидта: NL = 2.67 · 1025 1/м3 (показывает число молекул идеального газа в 1 м3 при НУ).
Молярная масса вещества μ (мю), [кг/моль] – это масса одного моля вещества.
μ = М · 10 -3 кг/моль, где М – относительная молекулярная (атомарная) масса вещества.
μ = mo · NA, где mo – масса одной молекулы, [кг].
Количество вещества ν (ню), [моль]:
ν =  , где m = moN – масса вещества, [кг]; N – число молекул (атомов) вещества.
, где m = moN – масса вещества, [кг]; N – число молекул (атомов) вещества.
Основные уравнения МКТ:  и р = n k T,
и р = n k T,
где  - давление идеального газа, [Па]
- давление идеального газа, [Па]
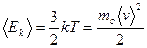 - средняя кинетическая энергия теплового движения молекул идеального газа (ИГ), [Дж],
- средняя кинетическая энергия теплового движения молекул идеального газа (ИГ), [Дж],
 - концентрация молекул газа,
- концентрация молекул газа, 
 - средняя квадратичная скорость теплового движения молекул ИГ, [м/с].
- средняя квадратичная скорость теплового движения молекул ИГ, [м/с].
k = 1.38 · 10 -23 Дж/К – постоянная Больцмана.
R = k·NA = 8.31 Дж/(моль·К) – универсальная газовая постоянная.
Т – абсолютная температура, [К], где Т = t oC + 273,
Законы идеального газа
Уравнение Менделеева – Клапейрона:  ,
,
где V – объём газа, [м3], р – давление газа, [Па].
если масса газа не изменяется (т.е. m = const), то справедливо уравнение Клапейрона (основное уравнение состояния ИГ):
 или
или  , если m = const
, если m = const
из основного уравнения Клапейрона можно получить другие законы, полагая один из параметров P, V или Т постоянными:
изотермический процесс, т. е. Т = const: PV = const закон Бойля – Мариотта.
изохорический процесс, т. е. V = const:  закон Шарля.
закон Шарля.
|
|
изобарический процесс, т. е. P = const:  закон Гей – Люссака.
закон Гей – Люссака.
Адиабатический процесс подчиняется уравнению Пуассона:  ,
,
где  - показатель Пуассона (или показатель адиабаты).
- показатель Пуассона (или показатель адиабаты).
Зависимость объёма V и давления Р от температуры:  при р = const
при р = const
 при V = const, где α – температурный коэффициент,
при V = const, где α – температурный коэффициент, 
Закон Дальтона: давление смеси газов равно сумме парциальных давлений каждого газа смеси, т.е. 
Парциальным называется давление, которое оказывал бы i-ый газ, если бы он один занимал весь объём, предоставленный смеси.
Для каждого i – го газа смеси справедлив закон Менделеева – Клайперона в виде

и для всей смеси справедлив закон Менделеева – Клайперона в виде
 , где
, где 
Тепловые процессы
Первое начало термодинамики:
Количество теплоты Q, переданное газу, идёт на изменение его внутренней энергии ΔU и на совершение газом работы А над внешними телами, т.е.
Q = ΔU + A
где  , причём i = 3 для одноатомных газов (O, H, He и т.д.)
, причём i = 3 для одноатомных газов (O, H, He и т.д.)
i = 5 для двуатомных газов (O2, H2, CO и т.д.)
i = 6 для трёх и более атомных газов (CO2, H2O и т.д.)
Работа идеального газа
если V = const, то А = 0,
если р = const, то 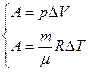 ,
,
если Т = const, то 
где  , Джоуль
, Джоуль
КПД теплового двигателя
η =  , где Аполезное = Q1 – Q2 – полезная работа двигателя, [Дж].
, где Аполезное = Q1 – Q2 – полезная работа двигателя, [Дж].
Q1 – количество теплоты, полученное газом от нагревателя, [Дж].
Q2 - количество теплоты, отданное газом холодильнику, [Дж].
КПД идеальной тепловой машины (машины Карно)
 η =
η =  , где Т1 – температура нагревателя, [К]
, где Т1 – температура нагревателя, [К]
Т2 – температура холодильника, [К]
Законы реального газа
- уравнение Ван-дер-Ваальса для одного моля газа 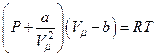
|
|
- уравнение Ван-дер-Ваальса для произвольной массы газа  ,
,
где  и
и  - постоянные Ван-дер-Ваальса
- постоянные Ван-дер-Ваальса






