Натуральный каучук получают из млечного сока (латекса) каучуконосного дерева гевеи, растущего в тропических лесах Бразилии.
При нагревании без доступа воздуха каучук распадается с образованием диенового углеводорода – 2- метилбутадиена-1,3 или изопрена. Каучук – это стереорегулярный полимер, в котором молекулы изопрена соединены друг с другом по схеме 1,4- присоединения с цис- конфигурацией полимерной цепи:

Стереорегулярное строение каучука
Молекулярная масса натурального каучука колеблется в пределах от 7 . 104 до 2,5 . 106.
транс - Полимер изопрена также встречается в природе в виде гуттаперчи.

Натуральный каучук обладает уникальным комплексом свойств: высокой текучестью, устойчивостью к износу, клейкостью, водо- и газонепроницаемостью. Для придания каучуку необходимых физико-механических свойств: прочности, эластичности, стойкости к действию растворителей и агрессивных химических сред – каучук подвергают вулканизации нагреванием до 130-140°С с серой. В упрощенном виде процесс вулканизации каучука можно представить следующим образом:

 Атомы серы присоединяются по месту разрыва некоторых двойных связей и линейные молекулы каучука "сшиваются" в более крупные трехмерные молекулы – получаетсярезина, которая по прочности значительно превосходит невулканизированный каучук. Наполненные активной сажей каучуки в виде резин используют для изготовления автомобильных шин и других резиновых изделий. Строение резины.
Атомы серы присоединяются по месту разрыва некоторых двойных связей и линейные молекулы каучука "сшиваются" в более крупные трехмерные молекулы – получаетсярезина, которая по прочности значительно превосходит невулканизированный каучук. Наполненные активной сажей каучуки в виде резин используют для изготовления автомобильных шин и других резиновых изделий. Строение резины.
В 1932 году С.В.Лебедев разработал способ синтеза синтетического каучука на основе бутадиена, получаемого из спирта. И лишь в пятидесятые годы отечественные ученые осуществили каталитическую стереополимеризацию диеновых углеводородов и получили стереорегулярный каучук, близкий по свойствам к натуральному каучуку. В настоящее время в промышленности выпускают каучук, в котором содержание звеньев изопрена, соединенных в положении 1,4, достигает 99%, тогда как в натуральном каучуке они составляют 98%. Кроме того, в промышленности получают синтетические каучуки на основе других мономеров – например, изобутилена, хлоропрена, и натуральный каучук утратил свое монопольное положение.
Для вулканизации каучука берётся немного серы 2 – 3 % от общей массы. Если добавить к каучуку более 30 % серы, то она присоединится по линии разрыва почти всех π – связей и образуется жёсткий материал – эбонит.
Вопросы для самоконтроля
1) Какие вещества называются углеводородами?
2) Какие типы углеводородов известны? Чем они отличаются по строению друг от друга?
3) Назовите классы непредельных углеводородов и особенности их строения.
4) Что называется гибридизацией? Какие типы гибридизации углерода вы знаете?
5) Какие виды изомерии вы знаете?
Вопрос № 1Диеновые углеводороды имеют общую формулу:
а) C nH2n+2
б) CnH2n
в) CnH2n-2
г) CnHn
Вопрос № 2 Кратные связи в углеводороде H3C - CH = CH - CH = CH2 называются:
а) Кумулированные
б) Сопряженные
в) Изолированные
Вопрос № 3 Название углеводорода с формулой CH2 = CH - C(CH3) = CH - CH(CH3) - C2H5
а) 3-метил-5-этилгексадиен-1,3
б) 2-этил-4-метилгексадиен-3,5
в) 3,5-диметилгептадиен-4,6
г) 3,5-диметилгептадиен-1,3
Вопрос № 4 Получение бутадиена-1,3 из этилового спирта называется реакцией:
а) Лебедева
б) Зелинского
в) Вюрца
г) Кучерова
Вопрос № 5 Алкадиены способны присоединять:
а) водород
б) галогеновороды
в) галогены
г) все ответы верны
Вопрос № 6 Для алкадиенов наиболее характерны реакции:
а) замещение
б) присоединение
в) обмен
г) изомерилизация
Вопрос № 7 Процессом вулканизации называют:
а) нагревание каучука с сажей
б) нагревание каучука с порошком серы
в) выдерживание каучука над жерлом вулкана
г) длительное нагревание сырого каучука
ПЛАН ЗАНЯТИЯ № 10
Дисциплина: Химия.
Тема: Алкины.
Цель занятия: изучить такой класс непредельных углеводородов как алкины, рассмотреть основные способы получения и химические свойства на примере ацетилена.
Планируемые результаты
Предметные: владеть основополагающими химическими понятиями: непредельные углеводороды, алкины, уметь давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
Метапредметные: использовать основные методов познания для выявления причинно-следственных связей;
Личностные: уметь использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности.
Норма времени: 2 часа
Вид занятия: Лекция
План занятия:
1. Ацетилен.
2. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация.
3. Применение ацетилена на основе свойств.
4. Межклассовая изомерия с алкадиенами.
Оснащение: Учебник.
Литература:
15. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
16. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Тема 10. Алкины.
План:
1) Ацетилен.
2) Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация.
3) Применение ацетилена на основе свойств.
4) Межклассовая изомерия с алкадиенами.
1Ацетилен.
Алкины – это углеводороды, содержащие в своей структуре тройную связь. Общая формула ацетиленовых углеводородов СnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Н - С = С – Н ацетилен
Общая формула алкинов CnH2n-2
Составим гомологический ряд алкинов
С2Н2
С10Н22
С7Н12
С6Н12
С4Н6
С5Н10
С5Н8
С4Н8
С3Н4
Номенклатура. По рациональной номенклатуре производные ацетилена рассматриваются как его замещенные, называются радикалы с прибавлением слова «ацетилен».

По систематической номенклатуре названия ацетиленовых углеводородов даются от соответствующих предельных углеводородов с заменой окончания на «-ин», нумерацию начинают с того конца, где ближе тройная связь:
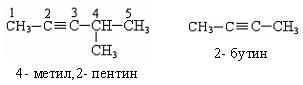
2. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация.
А) РЕАКЦИЯ ГАЛОГЕНИРОВАНИЯ
Происходит в две стадии по месту расположения пи- связи (сначала разрушается одна пи-связь, образуется алкен, затем вторая – образуется алкан).
1. Галогенирование (присоединение галогенов):
1 стадия. СН ≡ СН + Br2 (р-р) → СНВr = СНВr;
1,2-дибромэт ен
2 стадия. СНВr = CHBr + Br2 (р-р) → СНВr2— CHBr2
1,1,2,2-тетрабромэт ан
Суммарное уравнение: CH ≡CH + 2Br₂→CHBr₂—CHBr₂
Качественная реакция на пи-связь обесцвечивание бромной воды.
б) РЕАКЦИЯ ГИДРИРОВАНИЯ
СН = СН + Н2 ®. СН2 = СН2
Присоединение водорода:
СН ≡ СН + Н2 → Y
1 стадия: СН ≡ СН + Н2 → X;
2 стадия: X + H₂ → Y.
в) РЕАКЦИЯ ГИДРОГАЛОГЕНИРОВАНИЯ
СН ≡ СН + НСl → X
СН ≡ СН + НСl → СН2= СНСl винилхлорид
Продукт первой стадии винилхлорид используется в промышленности для реакций полимеризации получают полимер-поливинилхлорид (ПВХ) имеет важное промышленное значение.
г) ГИДРАТАЦИЯ
Реакция присоединения воды в присутствии солей ртути – реакция Кучерова:
СН ≡ СН + НОН → СН3—С = О ацетальдегид
 H
H
! Остальные алкины образуют кетоны
д) ОКИСЛЕНИЕ
1. Горение (закончить уравнение реакции):
С2Н2 + О2 →?
Ацетилен горит коптящим пламенем, т.к. соотношение атомов углерода и водорода в соединении одинаково.
2.*Обесцвечивание раствора перманганата калия КМnО4 качественная реакция на пи-связь:
СН ≡ СН + КМnО4 → СООН—СООН
щавелевая кислота
е) РЕАКЦИИ ПОЛИМЕРИЗАЦИИ
Реакции полимеризации
1.*Димеризация:
СН ≡ СН + СН ≡ СН → СН≡ С—СН=СН2 (CuCl)
бутен-1-ин-3 (винилацетилен)
2. Тримеризация:
СН ≡ СН + СН ≡ СН + СН ≡ СН → С6Н6
Бензол
(t=6000С, катализатор уголь активированный Сакт)
4. Применение ацетилена на основе свойств.
1) может применяться в качестве горючего при газовой сварке и резке металлов;
2) используется также для синтеза различных органических соединений;
3) в результате присоединения хлора к ацетилену получают растворитель – 1,1,2,2-тетрахлорэтан. Путем дальнейшей переработки тетрахлорэтана получаются другие хлорпроизводные;
4) при отщеплении хлороводорода от 1,1,2,2-тетрахлорэтана образуется трихлорэтен – растворитель высокого качества, который широко применяется при чистке одежды: СНСI = ССI2;
5) в больших количествах ацетилен идет на производство хлорэтена, или винилхлорида, с помощью полимеризации которого получается поливинилхлорид (используется для изоляции проводов, изготовления плащей, искусственной кожи, труб и других продуктов);
6) из ацетилена получаются и другие полимеры, которые необходимы в производстве пластмасс, каучуков и синтетических волокон.