По международной заместительной номенклатуре название кислоты производят от названия соответствующего углеводорода с добавлением окончания и слова кислота. Нумерацию цепи всегда начинают с атома углерода карбоксильной группы, поэтому в названиях положение функциональной группы не указывают. Например:
СН3 – СН2 – СН(С2Н5) – СН(СН3) – СН2 – СООН
2-метил-4-этилгексановая кислота
При составлении названий кислот также используют тривиальные названия, соответствующие наиболее длинной прямой цепи. В этом случае атомы углерода в прямой цепи обозначают греческими буквами, начиная с атома углерода, соседнего с карбоксильной группой:

Названия основных насыщенных карбоновых кислот приведены в таблице.
Внутри класса для предельных монокарбоновых кислот возможна только изомерия углеродной цепи. Метановая, этановая и пропановая кислоты изомеров не имеют.
Составу СH3COOH соответствуют 4 изомера.

Кроме изомерии по углеродному скелету, для монокарбоновых кислот характерна межклассовая изомерия сложным эфирам карбоновых кислот.
Например:

6. Получение карбоновых кислот окислением альдегидов. Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации. Применение уксусной кислоты на основе свойств. Высшие жирные кислоты на примере пальмитиновой и стеариновой.
Получение.
К общим способам получения предельных монокарбоновых кислот относят:
1. Окисление первичных спиртов, альдегидов, алканов по действиям различных окислителей:

2. В лаборатории карбоновые кислоты можно получить из солей, действуя на них серной кислотой при нагревании:

Физические свойства.
НСООН, СН3 СООН,…, С9 Н19 СООН - смешиваются с водой во всех отношениях
С10 Н21 СООН… - твердые вещества.

Среди кислот в отличие от альдегидов нет газообразных веществ. Низшие карбоновые кислоты – жидкости с острым запахом, хорошо растворимые в воде уменьшается, а кипения повышается. Высшие карбоновые кислоты – твердые вещества, без запаха, нерастворимые в воде.
Значения температур кипения карбоновых кислот аномально высокие. Причина этого – наличие водородных связей, благодаря которым кислоты существуют в основном в виде димеров:

Химические свойства.
Для предельных монокарбоновых кислот характерна высокая реакционная способность. Кислотные свойства обусловлены подвижностью атома водорода карбоксильной группы и являются общими с неорганическими кислотами. Рассмотрим основные общие свойства на примере уксусной кислоты.
1 - Диссоциация
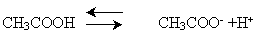
Ууниверсальная индикаторная бумага приобретает розовый цвет, а не красный как мы предполагаем, значит, уксусная кислота – слабая кислота, так же как и ее гомологи. В гомологическом ряду их сила уменьшается с ростом числа атомов углерода в молекуле:

2 - Взаимодействие с активными металлами
2 СН3СООН +Zn = (СН3СОО)2Zn +H2
ацетат цинка
3 - Взаимодействие с основными оксидами
2СН3СООН + СаО = (СН3СОО)2Са +Н2О
ацетат кальция
4 - Взаимодействие со щелочами
СН3СООН +NaOH = СН3СООNa +Н2О
ацетат натрия
5 - Взаимодействие с солями более слабых кислот:
2 СН3СООН +Na2CO3 = 2 СН3СООNa + H2O +CO2
Для карбоновых кислот так же как и для неорганических характерны реакции, идущие с замещением группы – ОН.
6 - Реакции этерификации

7 - Межмолекулярная дегидратация с образованием альдегидов
В предельных монокарбоновых кислотах атомы водорода у L – углеродного атома более подвижна, чем другие атомы водорода в радикале кислоты и могут замещаться на атомы галогена с образованием L – галогенкарбоновых кислот:

Применение.
Самостоятельная работа с учебникомГ.Е.Рудзитис, Ф.Г.Фельдман, 10 класс. Страница 129.
Вопросы для самоконтроля
1) Дайте определение карбоновым кислотам.
2) Охарактеризуйте строение карбоксильной группы (с записью на доске).
3) Приведите классификацию карбоновых кислот: а) по основности, б) по строению углеводородного радикала.
4) Запишите на доске общую формулу насыщенных монокарбоновых кислот.
5) Запишите электронную формулу карбоновой кислоты.
6) Укажите перераспределение электронной плотности в молекуле этого вещества.
7) Каким образом строение карбоновых кислот влияет на их свойства по сравнению спиртами и альдегидами.
8) Доказывают ли результаты опытов общность свойств неорганических и органических кислот?
9) Получите этиловый эфир уксусной кислоты, объясните при каких условиях идет процесс. Запишите уравнение реакции. С участием какой группы атомов в кислоте идет реакция?
10) Объясните процесс межмолекулярной дегидратации уксусной кислоты. Является ли эта реакция характерной и для неорганических кислот?
11) Объясните специфические свойства предельных монокарбоновых кислот на примере реакции хлорирования уксусной кислоты (все стадии).
12) Объясните как осуществляется название карбоновых кислот по международной заместительной номенклатуре. Объяснение произведите на примере карбоновой кислоты следующего строения:
CH3 – CH2 – CH(СН3) – CH(СН3) – CH2 - CООН
13) Каким образом можно назвать карбоновую кислоту по тривиальной номенклатуре? В качестве примера приведите кислоту следующего строения:
CH3 – C(СН3)2 – CH(СН3) – CООН
14) Рассмотрите кодопленку “Некоторые представители гомологического ряда насыщенных карбоновых кислот” и продемонстрируйте ее классу.
15) Какие виды изомерии характерны для предельных монокарбоновых кислот? Объясните на примерах состава CH3COOH и C4H7OОН. Все изомерные вещества назовите.
16) Объяснить возможности получения карбоновых кислот в лаборатории (на примере уксусной кислоты).
17) Записать уравнение реакций окисления: а) спиртов, б) альдегидов, в) алканов.
Вариант I
1. Какие из следующих соединений относятся к непредельным монокарбоновым кислотам?
а) СН2 = CH - COOH
б) СН3 – CH2 – COOH
в) HOOC – CH = CH - COOH
г) Н2С = C(СН3) - COOH
2. Как называется кислота следующего строения:
СН3 – CH(СН3) – CH(СН3) - COOH
а) 1, 2 – диметилбутановая кислота
б) 2, 3 – диметилбутановая кислота
в) 2, 3 – диметилгексановая кислота
г)  диметилмасляная кислота
диметилмасляная кислота
3. Найдите среди приведенных структурных формулу 2 – метилбутановой кислоты:
а) СН3 – СН2 – СН(СН3) – СООН
б) СН3 – СН(СН3) – СН2 – СООН
в) СН3 – С(СН3)2 – СООН
г) СН3 – С(СН3)2 – СН2 – СООН
4. Укажите вещества, которые получаются в результате реакции: 2СН3-СООН +2 Na =
а) Н2
б) Н2О
в) СН3 - СООNa
г) NaОН
5. Из каких веществ можно получить уксусную кислоту?
а) Н2SO4
б) Н2О
в) СН3 – СН 2ОН
г) С6Н5-ОН
Вариант II
1. Какие из следующих соединений относятся к дикарбоновым кислотам?
а) СН2 = СН – СООН
б) НООС - СООН
в) НООС- С6Н4 - СООН
г) СН3 - СООН
2. Как называется кислота следующего строения:
б) СН3 – CH(СН3) – COOH
а) н - бутановая
в) изомасляная
б) 2 – метилпропановая
г) 2 – метилбутановая
3. Найдите среди приведенных структурных формул формулу 2, 3 - диметилгексановой кислоы:
а) СН3 – СН(СН3) – СН(СН3) –СН2 – СН2 -СООН
б) СН3 – С(СН3)2 – С(СН3)2– СООН
в) СН3 – СН(СН3) – СН(СН3) – СООН
г) СН3 – СН2 – СН2 – СН(СН3) – СН(СН3) – СООН
4. С какими из перечисленных веществ реагируют уксусная кислота?
а) CO2
б) K
в) Na2S
г) HCl
5. Укажите вещества, которые образуются в результате следующего превращения: СН3СООН + Cl2 =
а) HCl
б) CH3COCl
в) CH2Cl COOH
г) HOCl
ПЛАН ЗАНЯТИЯ № 15
Дисциплина: Химия.
Тема: Сложные эфиры и жиры.
Цель занятия: Систематизировать знания о сложных эфирах, их строении, нахождении в природе и свойствах. Сформировать представление о жирах, их составе, свойствах и применении. Ознакомить с солями жиров – мылами.
Планируемые результаты
Предметные: сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
Метапредметные: использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи;
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1. Сложные эфиры.Получение сложных эфиров реакцией этерификации.
2. Сложные эфиры в природе, их значение. Применение сложных эфиров на основе свойств.
3. Жиры как сложные эфиры. Классификация жиров.
4. Химические свойства жиров: гидролиз и гидрирование жидких жиров.
5. Применение жиров на основе свойств.
6. Мыла.
Оснащение: Учебник.
Литература:
1. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.