План:
1. Понятие об альдегидах. Альдегидная группа как функциональная.
2. Формальдегид и его свойства: окисление в соответствующую кислоту,восстановление в соответствующий спирт.
3. Получение альдегидов окислением соответствующих спиртов. Применение формальдегида на основе его свойств.
4. Понятие о карбоновых кислотах. Карбоксильная группа как функциональная.
5. Гомологический ряд предельных однооснóвных карбоновых кислот.
6. Получение карбоновых кислот окислением альдегидов. Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации. Применение уксусной кислоты на основе свойств. Высшие жирные кислоты на примере пальмитиновой и стеариновой.
1. Понятие об альдегидах. Альдегидная группа как функциональная.
Альдегиды являются представителями карбонильных соединений.
Карбонильные соединения (оксосоединения) - это производные соединения углеводородов, содержащие в молекуле карбонильную группу - С=О.
Группа - 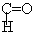 входящая в состав альдегидов называется альдегидной группой.
входящая в состав альдегидов называется альдегидной группой.
Альдегиды - это органические вещества, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
В результате эксперимента было установлено, что молекулярная формула формальдегида – СН2О. Согласно положениям теории строения органических веществ этой молекулярной формуле соответствует структурная формула:
Н – С = О
Н
Укажем в этой формуле типы связей. Сигма-связь существует между атомами углерода и водорода. Между атомами углерода и кислорода – одна сигма-связь и одна пи-связь.
Электронная плотность смещается от атома углерода к более электроотрицательному атому кислорода. Следовательно, атом углерода приобретает частичный положительный заряд, а атом кислорода – частичный отрицательный заряд.
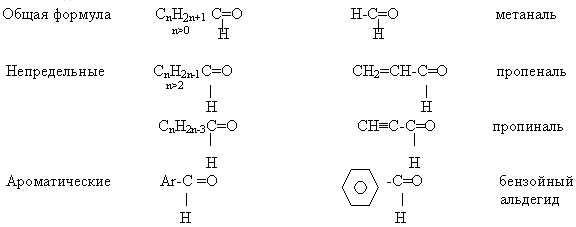
По международной номенклатуре названия альдегидам дают таким образом:
· прибавляют окончание «аль» к названию углеводорода с самой длинной углеродной цепью, включающей карбонильную группу, от которой и начинается нумерация цепи.
– метаналь;
– этаналь;
– пропаналь;
– 2-метилпропаналь;
– бутаналь;
– пентаналь.
Альдегиды сохранили исторические названия, соответствующие названиям органических кислот, в которые они превращаются при окислении:
¾ метаналь – муравьиный альдегид;
¾ этаналь – уксусный альдегид;
¾ пропаналь – пропионовый альдегид;
¾ бутаналь – масляный альдегид;
¾ пентаналь – валериановый альдегид.
Для метаналя и этаналя используют также исторически сложившиеся названия – формальдегид и ацетальдегид.
2. Формальдегид и его свойства: окисление в соответствующую кислоту, восстановление в соответствующий спирт.
Для формальдегида характерны реакции окисления и присоединения (в том числе и поликонденсации):
1 ) реакция окисления:
а) реакция окисления протекает очень легко – альдегиды способны отнимать кислород от многих соединений;
б) при нагревании формальдегида с аммиачным раствором оксида серебра (в воде оксид серебра нерастворим) происходит окисление формальдегида в муравьиную кислоту НСООН и восстановление серебра. Образование «серебряного зеркала» служит качественной реакцией на альдегидную группу;

г) альдегиды восстанавливают гидроксид меди (II) до гидроксида меди (I), который превращается в оранжевый оксид меди (I);
д) реакция протекает при нагревании: 2СuОН → Сu2О + Н2О;
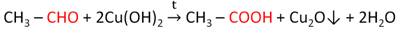
е) эта реакция также может быть использована для обнаружения альдегидов;
ж)Окислить альдегиды можно также K2Cr2O7, KMnO4 или кислородом воздуха в присутствии катализатора. При этом также образуются карбоновые кислоты. Например, при окислении пропионового альдегида кислородом воздуха в присутствии катализатора образуется пропановая кислота.
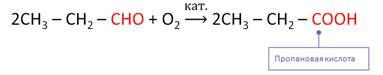
2) реакция присоединения:
а) реакция присоединения протекает за счет разрыва двойной связи карбонильной группы альдегида;
б) присоединение водорода, которое происходит при пропускании смеси формальдегида и водорода над нагретым катализатором – порошком никеля или платины, приводит к восстановлению альдегида в спирт;
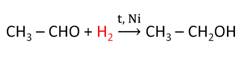
в) формальдегид присоединяет также аммиак, гидросульфит натрия и другие соединения.
3. Получение альдегидов окислением соответствующих спиртов. Применение формальдегида на основе его свойств.
1) общим способом получения альдегидов служит окисление спиртов;
2) если накалить в пламени спиртовки спираль из медной проволочки и опустить ее в пробирку со спиртом, то проволочка, которая покрывается при нагревании темным налетом оксида меди (II), в спирте становится блестящей;

3) обнаруживается также запах альдегида.
С помощью такой реакции получается формальдегид в промышленности.
Для получения формальдегида через реактор с раскаленной сеткой из меди или серебра пропускается смесь паров метилового спирта с воздухом;
4) при лабораторном получении альдегидов для окисления спиртов могут быть использованы и другие окислители, например перманганат калия;
5) при образовании альдегида спирт, или алкоголь, подвергается дегидрированию.

Особенности реакции гидратации ацетилена:
а) сначала идет присоединение воды к ацетилену по месту одной π-связи;
б) образуется виниловый спирт;
в) непредельные спирты, в которых гидроксильная группа находится у атома углерода, который связан двойной связью, неустойчивы и легко изомеризуются;
г) виниловый спирт превращается в альдегид:
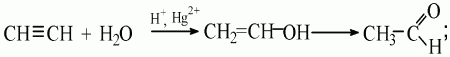
д) реакция легко осуществляется, если пропускать ацетилен в нагретую воду, которая содержит серную кислоту и оксид ртути (II);
е) через несколько минут в приемнике можно обнаружить раствор альдегида.
В последние годы разработан и получает распространение способ получения ацетальдегида окислением этилена кислородом в присутствии хлоридов палладия и меди.
Способы получения формальдегида:
1) в промышленности формальдегид получают из метанола, пропуская пары спирта вместе с воздухом над нагретым до 300 °C медным катализатором: 2СН3ОН + O2 → 2НСНО + 2Н2О;
2) важным промышленным способом является также окисление метана воздухом при 400–600 °C в присутствии небольшого количества оксида азота в качестве катализатора: СН4 + O2 → СН2О + Н2О.
Применение формальдегида: 1) Из альдегидов наибольшее применение имеет формальдегид. Особенности применения формальдегида: используется обычно в виде водного раствора – формалина; многие способы применения формальдегида основаны на свойстве свертывать белки; в сельском хозяйстве формалин необходим для протравливания семян; формалин применяется в кожевенном производстве; формалин оказывает дубящее действие на белки кожи, делает их более твердыми, негниющими; формалин применяется также для сохранения биологических препаратов; при взаимодействии формальдегида с аммиаком получается широко известное лекарственное вещество уротропин.
2)Основная масса формальдегида идет на получение фенолформальдегидных пластмасс, из которых изготавливаются: а) электротехнические изделия; б) детали машин и др.
3) Формальдегид в больших количествах применяется для производства фенолоформальдегидных смол;
4) Он служит исходным веществом для производства красителей, синтетического каучука, лекарственных веществ, взрывчатых веществ и др.
5)Ацетальдегид (уксусный альдегид) в больших количествах используется для производства уксусной кислоты.
6)Восстановлением ацетальдегида в некоторых странах получают этиловый спирт.
4. Понятие о карбоновых кислотах. Карбоксильная группа как функциональная.
Карбоновые кислоты – это производные УВ, содержащие функциональную карбоксильную группу – COOH.
Карбоксильная группа состоит из карбонильной и гидроксильной групп.
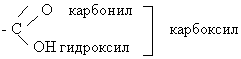
По основности кислоты делятся на одноосновные (монокарбоновые), двухосновные (дикарбоновые), трехосновные (трикарбоновые) и т.д. (Демонстрация слайдов).
В зависимости от строения УВ радикала карбоновые кислоты делятся на:
предельные (насыщенные), R – алкил;
непредельные (ненасыщенные) – производные непредельные УВ;
ароматические – производные ароматических УВ.
Наибольшее значение имеют насыщенные монокарбоновые кислоты, их общая формула:
Сn Н2n+1 - СООН 
Электронное строение.
Карбоксильная группа содержит высокополяризованную карбонильную группу. Атом углерода карбонильной группы, имеющий частичный положительный заряд, оттягивает на себя электроны связи С – О. Неподеленная пара электронов атома кислорода гидроксильной группы взаимодействует с электронами  – связи карбонильной группы. Это приводит к большему оттягиванию электронов от атома водорода гидроксильной группы увеличению полярности связи О – Н по сравнению со спиртами, а также уменьшению положительного заряда на атоме углерода карбонильной группы кислот по сравнению с альдегидами. В отличие от спиртов, кислоты диссоциируют с образованием ионов водорода Н+. В отличие от альдегидов для них не характерны реакции присоединения по двойной связи.
– связи карбонильной группы. Это приводит к большему оттягиванию электронов от атома водорода гидроксильной группы увеличению полярности связи О – Н по сравнению со спиртами, а также уменьшению положительного заряда на атоме углерода карбонильной группы кислот по сравнению с альдегидами. В отличие от спиртов, кислоты диссоциируют с образованием ионов водорода Н+. В отличие от альдегидов для них не характерны реакции присоединения по двойной связи.
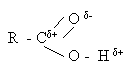
5. Гомологический ряд предельных однооснóвных карбоновых кислот.