Предисловие.
Будучи огорчен качеством преподавания химии в РНИИМУ, и тем более, способом последующего контроля качества образования – тестами, я решил оказать посильную помощь студентам в сдаче оных. Пособие представляет собой краткую, насколько возможно, инструкцию, как минимально загрузив голову таки сдать этот окаянный тест. Я исследовал большое их количество, обобщил результаты.
На каждый вид вопросов я постарался дать ответ, в меру научный, чтобы все-таки не слишком уйти от своих химических корней, но и достаточно ясный, чтобы он мог быть воспринят среднестатистическим студентом. Теперь я представляю свой труд для использования широкой общественностью, надеюсь, моё творение сможет послужить к чьей-нибудь пользе.
С одной стороны, тема имеет глубокие корни. В биохимии, которую предстоит изучать на втором курсе, есть флешбеки вот сюда. С другой стороны, тест недостаточно раскрывает суть теории Брёнстеда. Пожалуйста, внимательно слушайте преподавателей на паре, по возможности, читайте умные книжки. Мы же, как повелось, опишем тактику решения теста, сколь бы странным и далёким от темы он ни был. Не так уж он и далёк, между прочим.
Конечно, многим хотелось бы иметь готовые ответы и не париться. Думаю, что за годы работы eois общественность накопила некоторый объем ответов, он постепенно совершенствуется, доля верных ответов растет, уже в 2016 она была больше 70%. Правда, обновление вопросов в 2017 добавило веселья. Однако, в отношении химии мне это кажется неудачным путем. Объясню, почему я так считаю. Во-первых, вопросов большое количество, и они, как назло, очень похожи. Это делает трудным списывание с правильных ответов, и, одновременно, делает тесты уязвимыми к методичкам вот такого плана, с разбором вопросов на группы и злой иронией по этому поводу. Во-вторых, некоторые персонажи, как Карина, например, почему-то борются со списыванием, что делает этот процесс не самым простым трюком. А глядя на всё это глобально, по-моему, все же лучше что-то понимать и мыслить, чем списывать.
Заранее благодарен за адекватные комментарии, дополнения и исправления к тексту. Текст создан исключительно из гуманных соображений и распространяется безвозмездно.
Удачи, ни пуха, ни пера, дорогие любители химии.
Алексей «Леша-химик» Федоров, Е., L. и А.
07.10.2017.
Тема 6. Электролиты и рН.
Введение:
Просим обратить пристальное внимание на введение! Очень важно разобраться, что здесь написано. В вопросах этой темы могут встречаться вещества 7 видов.
| Тип | Пример |
| Сильная кислота | HCl (хлорид), HBr (бромид), HI (йодид), HNO3 (нитрат), H2SO4 (сульфат), H2CrO4 (хромат), H2Cr2O7 (дихромат), HClO3 (хлорат), HClO4 (перхлорат) |
| Сильные основания, щелочи | NaOH, LiOH, RbOH, KOH, CsOH, Ca(OH)2, Ba(OH)2, Sr(OH)2 |
| Слабые кислоты | HF (фторид), H2S (сульфид), H2SO3 (сульфит), HNO2 (нитрит), H3PO4 (фосфат), H2СO3 (карбонат), H2SiО3 (силикат), HClO (гипохлорит), HCN (цианид), органические кислоты (HCOОH (формиат), CH3COOH (ацетат), ClCH2COOH (это хлоруксусная кислота, ДА! Такое тоже бывает. Соль — хлорацетат)…) |
| Слабые основания | NH3, амины (CH3NH2, C2H5NH2, (CH3)2NH…), нерастворимые гидроксиды (Zn(OH)2, Al(OH)3…) |
| Соль сильного основание и сильной кислоты | KCl,NaCl, CaI2, Rb2SO4, Ca(NO3)2 |
| Соль сильного основание и слабой кислоты | Сa(NO2)2, KF, K3PO4, Na2SO3 |
| Соль слабого основания и сильной кислоты | NH4Cl, [(CH3)2NH2]2SO4 |
| Кислые соли | NaHCO3, KHS, LIH2PO4 |
Обратите внимание на разницу:
1) между аминами и их солями (солями слабых основания и сильных кислот CH3NH2 – амин, слабое снование, CH3NH3[Cl] – это соль слабого основания и сильной кислоты, метиламмонийхлорид! Амины – это слабые основания, а соли аминов — соли слабых оснований с сильными кислотами.
2) Обратите внимание на как бы парные кислоты, как например HNO2 (слабая) и HNO3 (сильная), не перепутайте. Есть полуэмипиреческое правило L, если в кислоте на 1 О больше, чем Н, то она слабая, если на 2 О больше, чем Н, то сильная.
3) В скобках после кислот написано название их солей, т.е. соль СН3СООН называется ацетат и это соль слабой кислоты. Вещества могут быть заданы и названиями, тоже храните эту информацию где-то рядом. Может встречаться дичь типа стеарата/пальмитата/пирувата — формулы не приводим, но всё это соли слабых кислот.
Внимание! В тесте более чем в половине приведенных вопросов решение начинается с того, что дано некое вещество, и нужно определить, какого оно класса: сильная или слабая кислота, или основание, или соль, и т.д. 100% точно убедитесь, что Вы научились разбираться. Пожалуйста, обратите на это огромное внимание! Мы не шутим.
Типичные вопросы:
1. Вещество и область pH.
Пример:

изи…
Как с этим бороться:
Сначала надо понять, какие типы веществ даны. Вспомните введение! Мы не шутили, как видите.
Cильные и слабые кислоты, соли слабых оснований и сильных кислот — pH<7
Соли сильных оснований с сильными кислотами, кислые соли — pH≈7
Сильные и слабые основания, соли сильных оснований и слабых кислот — pH>7
ОТВЕТ: яблочная кислота (это кислота, охуеть, да?) – A
Ацетат Бария – С
Нитрат Бария (это две какие-то соли, тут уже не так весело) – В
2. Вещество, возрастание и убывание рН.
Пример:

Пока тоже ничего особенного…
Как с этим бороться:
Сначала определяем типы веществ, снова возвращаемся к введению. Затем находим эти вещества на шкале.
Для решения этих вопросов удобно воспользоваться шкалой возрастания рН:
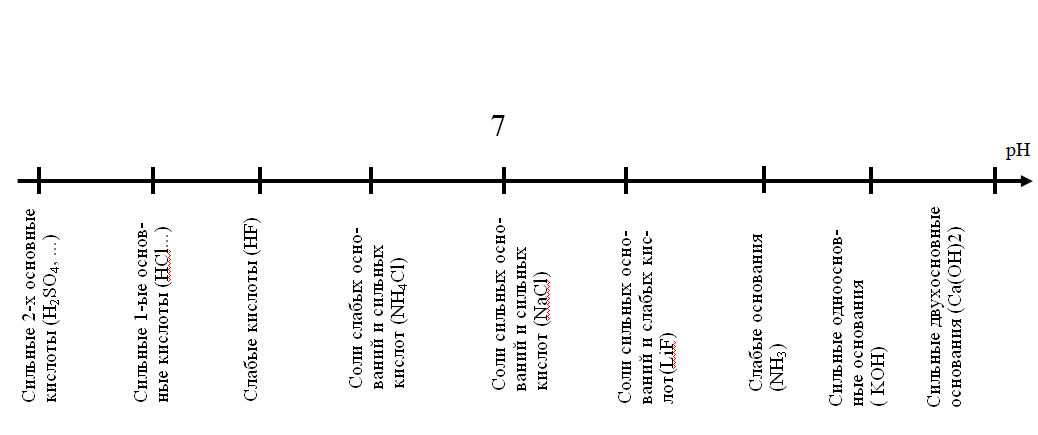
Из данных на шкале девяти веществ нам дано всегда 4, надо определить, что нам дано, и расположить в том порядке, что нам дано. Ну и расположить.
ОТВЕТ:
HNO3 (сильная кислота), HNO2 (слабая кислота), NaNO3 (соль сильное о.+сильная к.), NaOH (основание). Пожалуйста, не перепутайте, где нужно располагать в порядке возрастания, а где в порядке убывания, это хорошиий способ зафейлить лёгкий вопрос и потерять балл.
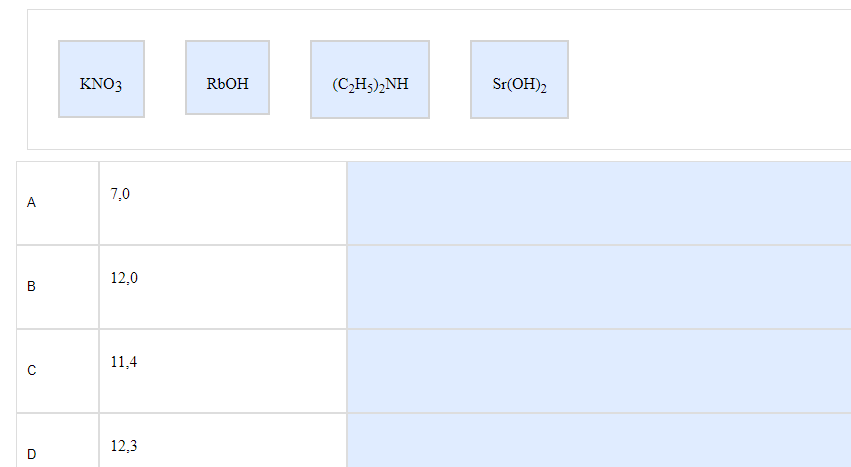
3. Вещество и значение рН.
Пример:
Аналогично прошлому…
Как с этим бороться:
Вопрос решается также, как и предыдущий.
Сначала определяем типы веществ (основания, соли, кислоты и тд). Снова, внимание на введение. Не ленитесь возвращеться туда, если не уверены. Самому сильной и кислой кислоте в соответствие ставим самую маленькую цифру, самой щелочному основанию – самую большую цифру.
ОТВЕТ: KNO3 =7
Амин =11,4
RbOH = 12,0
Sr(OH)2 = 12,3
4. Вещество и свойства:
Пример:

Ну так…
Как с этим бороться:
В общем виде это решается довольно сложно. Кислота – это частица способная отдать H+, основания – это частица, способная присоединить H+. (Определение Брёнстеда, между прочим).
Кислотами являются (очевидно, лол) кислоты, и сильные, и слабые, но кроме того кислотами являются соли аминов и аммиака. Например, аммоний способен отдать Н+, верно?
NH4+ ↔ NH3 + H+
Следовательно NH4+ – это кислота. Ещё кислотой является странная, пугающая конструкция Н3О+. Зовут это чудо ион гидроксония, образовался он путём присоединения Н+ к воде, и теперь может быть оторван обратно, поэтому гидроксоний — кислота. Грубо и не всегда точно, но можно ориентироваться, что обычно кислота это или сама кислота как есть или что-то с «+».
Основания — NH3, другие амины, так же OH- и остатки от кислот, например, фторид может присоединить Н+,
F-+ H+ ↔ HF
Следовательно, F- – это основание. Грубо и так же не всегда точно можно ориентироваться, что амины или что-то с «-» скорее всего, окажется основанием.
Если частица способна присоединять и отдавать Н+, то она — и основание, и кислота. Примеры: остатки кислых солей, аминокислоты в виде «+/-». Кроме того, хоть и не очевидно, но и кислотой, и основанием может быть вода. Оцените, ведь могут быть процессы: ОН-↔Н2О↔Н3О+? Вода в одну сторону отдаёт, в другую принимает Н+. Значит и кислота, и основание, на фене это называется амфолит. Решите больше примеров, чтобы увидеть, какую хуиту могут подлить.
5. Кислотно-основные пары.
Пример: Соотнесите кислоту из левой колонки с основанием из правой колонки так, чтобы они образовали сопряженную кислотно-основную пару:

…
Как с этим бороться:
Очень легкий вопрос! Кислотно-основные пары – это два одинаковых вещества, которые отличаются на один H+, например NH3 и NH4+. Нет, тут нет наёбки. Да, тут всё так просто. Важно, чтобы они отличались именно на один H+.
Например,
HPO42- и H2PO4- – это кислотно-основная пара.
HPO42- и H3PO4- – это не кислотно-основная пара.
ОТВЕТ:
Догадайтесь сами
6. Протолитические равновесия.
Пример:

Нууууу, уже так…
Как с этим бороться:
Протолитическое равновесие – это реакция, в которой отдается или присоединяется H+
Грубо можно сказать, что если в реакции есть кислотно-основная пара (см. пред. вопрос), то это «элементарный акт» реакции протолитического равновесия, как об этом написано в вопросе. Важно, чтобы отличие было именно в один Н+! В два и более, это уже не элементарный акт протолитического равновесия. Например, Н3РО4 ↔ Н2РО4- + Н+ считается протолитическим. равновесием, Н3РО4 ↔ РО43- + 3 Н+ не считается. Внимательно осмотрите реакции. Вещество может присоединять/отдавать Н+ из среды, например, Н3РО4 ↔ Н2РО4- + Н+, но это бывает редко. Чаще вещества передают Н+ друг другу. Очень часто в этом участвует вода, например, HBr + H2O ↔ H3O+ + Br-. Тут кислота передаёт воде Н+, вода переходит в гидроксониий. Кислотно-основная пара, как положено, налицо, значит равновесие.
7. Подбор формул.
Пример:

Тоже изи…
Как с этим бороться:
Для подбора формул используем таблицу из методички стр. 33. Хотя это и так у всех есть, для краткости поисков приведём её тут.
| Сильная кислота | 
|
| Сильное основание | 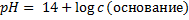
|
| Слабая кислота | 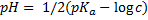
|
| Слабое основание | 
|
| Соль сильного основания и сильной кислоты |  (да, тут нет расчетов) (да, тут нет расчетов)
|
| Соль сильного основания и слабой кислоты | 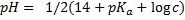
|
| Соль слабого основания и сильной кислоты | 
|
| Кислая соль | 
|
Заметим, что есть несколько подводных граблей.
1) Сильные кислоты и основания бывают двухосновными, например H2SO4 или Ba(OH)2. Для них в формуле концентрация умножается на 2, то есть
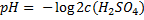
Связано с тем, что при диссоциации на 1 молекулу кислоты образуется 2 Н+, с основанием аналогично. Кстати, в примере как раз об этом, ответ
2) Слабые двухосновные кислоты, может быть дано две константы диссоциации рКа1 и рКа2. Спраедливо может возникнуть вопрос какого хуя тут творится?!?! какую константу следует использовать. Ответ — только первую, вторая нахуй не нужна для этого вопроса. Объяснение, если оно кому-то интересно: слабые кислоты диссоциируют по первой ступени, выделяющийся ион Н+ смещает равновесие по второй ступени практически полностью в сторону подавления диссоциации.
3) Соли слабых двухосновных кислот с сильными основаниями, та же херня, тоже две константы. Тут нужна вторая, только рКа2. Для фосфорной кислоты брать рКа3. Короче, берётся большая константа.
4) Гидрофосфаты и дигидрофосфаты, кислые соли фосфорной кислоты. Т.к. фосфорная кислота трёхосновная, то дано будет три (АААА!!!! Что творится, ёб твою мать) константы диссоциации: рКа1, рКа2, рКа3. Для солей НРО42- рН считается по 2-ой и 3-ей константам, а для Н2РО4- по 1-ой и 2-ой:

 а вот объяснений не приводим.
а вот объяснений не приводим.
8. Задачи.
Пример:

Приведём решение сразу, многим же не терпится, и многие уже почти догадались, как это делать. Амин – это слабое основание. Следовательно, формула из расчёта как у слабых оснований:
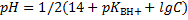
В дано все есть, ёпта! Подставляем и считаем. Ответ 11,6

Оставим для самостоятельного решения.
Как с этим бороться:
Обязательно научитесь решать задачи данного вида, их три или четыре штуки на тест. Без них даже порог может не получится.
1) Определяем тип вещества. Это делается так же, как описано во введении. Не поленитесь, если не уверены, ещё раз вернуться туда. В соответствии подбираем формулу, как в 9 вопросе. Косвенно может помочь дано. Если там рКа — то вещество в задаче либо слабая кислота, либо её соль, если рКвн+ — то слабое основание или его соль.
2) Хернем в формулу данные из дано.
3) Рассчитаем и получим ответ. Сначала считаем логарифм, потом всё остальное.
Решение из примера про HF:
Слабая кислота, значит формула
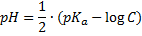
С подстановкой цифр
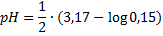
Считаем логарифм

Логарифм всегда должен быть отрицательным, это важно. Если нет — пересчитывайте. Для элиты от математики напоминаем, что минус на минус даёт плюс, но плюс на минус — таки минус.

Обратите внимание на подводные грабли, описанные в прошлом вопросе. Двухосновные кислоты, выбор из нескольких констант и т.д. Тут это всё тоже может быть надо.
При работе с подопытными обнаружены следующие особенности:
1) Тупо неправильные расчёты. Пересчиитывайте несколько раз, а то потом опять начнётся, «хули у меня тут неправильно?…». ВНИМАТЕЛЬНО БЛЕАТ НАДО ВСЁ ДЕЛАТЬ!!! Пожалуйста.
2) Обратите внимание на интервалы. У кислот рН меньше 7, у оснований больше 7. У солей, в зависимости от происхождения, тоже есть определённость. Если у HCN (слабая кислота) рН=10,7, то вы что-то делаете неправильно.
3) Округление. Обращайте внимание, до какого знака просят округлять. Вроде бы всегда до десятых. Это значит, что рН=12 неправильно, рН=12,0 правильно. Напоминаем, что по правилам 5 и дальше округляется до большего. Например, 5,55 округляется до 5,6. Но 5,54 округляется до 5,5. Дробная часть отделяется запятой, а не точкой.
Кроме того, найдена пара действительно сложных примеров.
· KHSO4. Формально кислая соль, но констант рКа не дадут, и применить формулу из таблицы нельзя. Да и не нужно. Считать по формуле как для сильной одноосновной кислоты, рН= - lg C. До причин, почему так, лучше не докапываться.
· (NH4)2SO4. Соль слабого основания и сильной кислоты. Формула как в таблице. Нюанс в том, что слабых оснований как бы х2, поэтому концентрацию в той формуле надо умножить на 2. В остальном расчёт обычный.
· Ждём новых сюрпризов…
9. Гидролиз.
Пример:

Олдскул…
Как с этим бороться:
КАК В ШКОЛЕ!
Соли сильных оснований и сильных кислот – гидролиза нет.
Соли сильных оснований и слабых кислот – гидролиз по аниону.
Соли слабых оснований и сильных кислот – по катиону.
Соли слабых оснований и слабых кислот — по катиону и аниону. Нигде больше в тесте такой тип солей не встречался, поэтому толком не описан.
Приложение. Таблица стр. 33, методичка с САРС-ами.
Настоятельно рекомендуется к подробному изучению, 100% годнота.
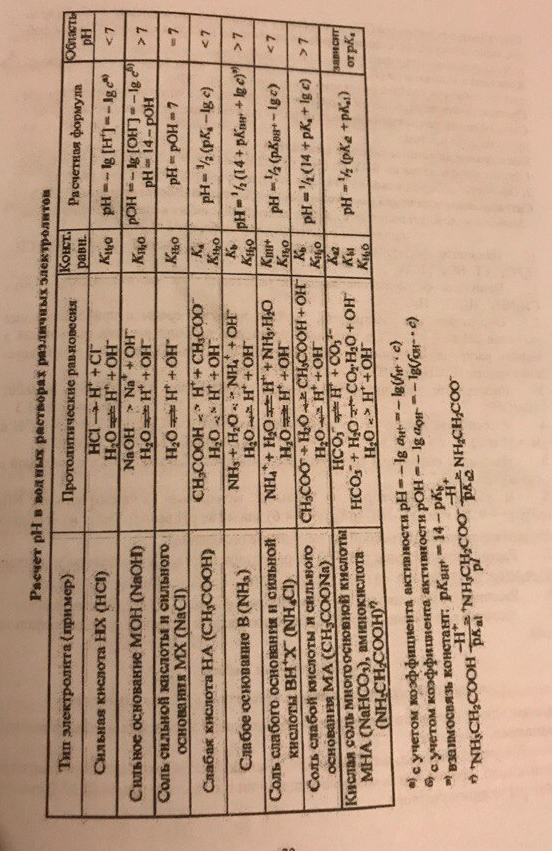
Как обычно, мы проверяем нашу теорию на себе. Честно заметим, что на этот раз десятка далась нам не с первой попытки — расчёты действительно отравляют жизнь.

Спасибо за внимание!

Если Вам понравилось, вы можете поддержать нас тут
https://vk.com/mars_him_prom
через функцию «поддержать…»