ТЕМА: ОСНОВНЫЕ ТИПЫХИМИЧЕСКИХ РЕАКЦИЙ
Вопросы:
Понятие химическое вещество и химическая реакция. Основные типы химических реакций.
Классификация химических реакций.
– в зависимости от механизма реакции;
– по признаку изменения числа исходных и конечных веществ реакции;
– по признаку изменения степеней окисления элементов, которые входят в состав реагирующих веществ;
– по признаку выделения или поглощения энергии реакции;
– по признаку обратимости реакции
I. Понятие химическое в-во и хим. реакция.
Химическое вещество – эта любая совокупность атомов и молекул. Химическое вещество характеризуется составом и строением. Состав бывает качественный и количественный.
Качественный состав – это те элементы, из которых состоит вещество
Н2О→Н и О
Количественный состав – это соотношение между элементами:
2 атома Н и 1 атом О.
Строение вещества – это порядок связей между атомами, характер этих связей и взаимное расположение атомов в пространстве.
Например: Н2О – молекулярная формула,
Н–О–Н структурная формула
Химические вещества бывают простые и сложные.
Простое вещество состоит из атомов одного элемента.
Сложное вещество состоит из атомов различных элементов.
Все вещества обладают физико-химическими свойствами Агрегатным состоянием, запахом, Ткип., Тпл. И т.д.
Химическое свойство в-ва – это способность вступать во взаимодействие с другими веществами или претерпевать иные изменения, приводящие к образованию новых веществ с иным составом и строением и свойствами.
Явления, при которых из одних веществ образуются другие, называются химическими явлениями или химическими реакциями.
Химические реакции записываются при помощи уравнения.
А+В=С+Д,
А и В – исходные в-ва (реагенты)
С и Д – конечные в-ва (продукты реакции)
Классификация химических реакций.
Химические реакции классифицируют по 5 различным признакам. Одна и та же реакция в зависимостиот признака классификации может относиться к разным типам реакций.
Рассмотрим некоторые из признаков классификации.
I. В зависимости от механизма реакции могут быть отнесены к простым и сложным.
Простые реакции — это реакции, включающие один химический этап. Это крайне редкий случай. Как правило, химический процесс - это сложная реакция, причем в ней на промежуточных стадиях участвуют активированные комплексы, свободные радикалы, ионы.
Сложные реакции — это реакции, включающие более одного химического этапа. К сложным реакциям относятся параллельные, последовательные и сопряженные реакции.
1) Если исходное вещество одновременно участвует в нескольких реакциях, приводящих к образованию различных продуктов, то такие реакции называются параллельными.
Так, реакция разложения бертолетовой соли (хлорат калия) при умеренно высоких температурах идет одновременно в двух направлениях, хотя условия преимущественного прохождения реакции в том или в другом направлении могут быть разные:

Общая скорость системы параллельных реакций (т. е. скорость превращения исходного вещества) равна сумме скоростей отдельных реакций. В случае же, когда скорости параллельных реакций сильно различаются между собой, суммарная скорость определяется в первую очередь скоростью наиболее быстрой из них.

2) Последовательными реакциями называются реакции, при которых продукт начальной реакции является исходным веществом для следующей реакции.
Последовательные реакции протекают согласно схемам:


Таковы, например, реакции омыления эфиров двухосновных кислот щелочью. В последовательных реакциях скорость процесса в целом определяется скоростью самой медленной стадии.
3) Сопряженные реакции, это реакции одна из которых идет самопроизвольно, тогда, как другая имеет место только в присутствии первой. В таком случае говорят, что одна реакция индуцирует протекание другой, т. е. имеет место химическая индукция. Идущая самопроизвольно первая реакция называется первичной, индуцируемая реакция - вторичной.
Сопряженные реакции протекают по схеме:

К сопряженным реакциям относят цепные реакции, протекающие по свободно-радикальному механизму.
Свободный радикал – это атом, имеющий неспаренный электрон и обладающий высокой химической активностью
Особым примером сопряженных реакций является реакция между хлором и водородом. При температуре 150—250°С в темноте реакция практически не идет. Однако она протекает с высокой скоростью в тех же условиях в присутствии паров натрия:
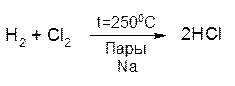
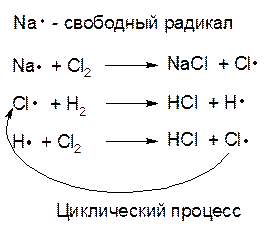

Это - пример так называемой цепной реакции, протекающей по радикально-цепному механизму. При цепном процессе имеет место цепочка реакций, в каждой из которых образуется молекула продукта и одновременно — свободный атом или, в общем случае, радикал, т. е. фрагмент молекулы, имеющий неспаренный электрон. Свободные радикалы химически активны, и время их жизни в химической системе невелико — они быстро реагируют либо с молекулами, либо с другими свободными радикалами. Когда свободный радикал реагирует с другой молекулой исходного вещества, образуется еще одна молекула продукта и новый радикал и т. д. Длина такой цепи может быть очень большой (десятки тысяч элементарных актов взаимодействия). Одновременный обрыв двух цепей происходит тогда, когда два свободных радикала (или свободных атома) сталкиваются друг с другом и реагируют с образованием молекулы (реакция рекомбинации). Для рассмотренной выше цепной реакции между водородом и хлором имеют место следующие элементарные акты обрыва кинетической цепи:
Для того чтобы свободные атомы соединились в молекулу, необходимо присутствие третьей частицы или твердой поверхности, в противном случае образовавшаяся молекула обладала бы запасом энергии, равным тому, который необходим для ее распада; не отдав эту энергию третьей частице или твердой поверхности, она снова распалась бы. Поэтому для цепных реакций характерно влияние на скорость реакции размеров, материала и формы сосуда, в котором протекает реакция. Для этих реакций характерна также чувствительность к следам примесей, прекращающих реакцию за счет обрыва цепей или же, наоборот, вызывающих ее за счет инициирования цепей.
II. По признаку изменения числа исходных и конечных веществ реакции можно выделить такие типы:
1) реакции соединения, при которыхиз двух или нескольких веществ получают одно вещество:
в общем виде А + В+... → С;
2Mg + О2 → 2MgO;
SO2 + Н2О → Н2SО3
2) реакции разложения, при которыхиз одноговеществаобразуется несколько веществ:
в общем виде С → А + В...;
t
2HgO → 2Hg + O2;
t
Сu (ОН)2 → СuО + Н2О
3) реакции замещения, при которых простое вещество замещает составную часть сложного вещества и в результате образуются новое простое и новое сложное вещества:
в общем виде АВ + С → АС + В;
Н2SО4 + Zn → ZnSO4 + Н2↑
Fe + CuSO4 → FeSO4 + Cu
4) реакции обмена, при которых молекулы сложных веществ обмениваются своими составными частями:
или в общем виде AB + CD → AD + CB,
HCl + NaOH → NaCl + H2O
BaCl2 +Н2SО4 → BaSO4 ↓ + 2НCl
III. По признаку изменения степеней окисления элементов, которые входят в состав реагирующих веществ, выделяют реакции, идущие без изменения степеней окисления элементов, и на окислительно-восстановительные (идущие с изменением степеней, окисления элементов).
1. Реакции, идущие без изменения степеней окисления элементов:
SO2 + Н2O = H2SO3
СаСО3 = СаО+СО2
A1(ОН)3 + 3HС1 = AlCl3 + 3H2O
2. Окислительно-восстановительные реакции: