МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение высшего образования «Южный федеральный университет»
Химический факультет
Кафедра аналитической химии
Дмитриев Дмитрий Олегович
«Анализ воды »
КУРСОВОЙ ПРОЕКТ
По дисциплине – Аналитическая химия
Научный руководитель – к.х.н., ассистент Тягливый Александр Сергеевич
Ростов-на-Дону – 2017
СОДЕРЖАНИЕ
| 1. | Функции и задачи лаборатории | |
| 2. | Характеристика анализируемой продукции | |
| 3. | Требования предъявляемые к природной воде | |
| 4. | Жёсткая и мягкая вода | |
| 5. | Методики анализов | |
| 6. | Проведение анализа | |
| 7. | Вывод | |
| 8. | Список использованной литературы | |
| 9. | Дневник практики |
Функции и задачи лаборатории
Основными задачами лаборатории является выполнение опытно-исследовательских работ, обеспечивающих внедрение и освоение новой техники и технологии при использовании современных достижений, направленных на интенсификацию действующих цехов, улучшению их экономических показателей, повышения качества выпускаемой продукции, охраны окружающей среды.
Во исполнении указанных задач лаборатория проводит работы по:
- Осуществление с требуемой точностью и достоверностью количественного химического и микробиологического анализов проб питьевой воды, сточных вод и промышленных стоков с целью установления соответствия их качества требованиям нормативных документов;
- Выполнение в полном объёме «Рабочей программы производственного контроля качества питьевой воды», контроль эффективности очистки питьевой воды, а также «Графика производственного контроля качества сточных вод и промышленных стоков».
- Подготовка исходных данных для разработки нормативно-технической документации для предприятий и принятия решений по улучшению качества воды согласно санитарно-эпидемиологического надзора и сбросов.
- Подбор, освоение и внедрение новых методик для анализа состояния качества питьевой, сточной воды.
- Усовершенствованию технологических процессов и полному освоению производственных мощностей.
- Улучшению методов утилизации промышленных отходов. [1]
Характеристика анализируемой продукции
Вода (Н2О) – жидкость без запаха, вкуса, цвета; самое распространенное природное соединение.
По физико-химическим свойствам В. отличается аномальным характером констант, которые определяют многие физические и биологические процессы на Земле. Плотность воды возрастает в интервале 100–4°, при дальнейшем охлаждении уменьшается, а при замерзании скачкообразно падает. Поэтому в реках и озерах лед как более легкий располагается на поверхности, создавая необходимые условия для сохранения жизни в водных экологических системах. Морская вода превращается в лед, не достигая наибольшей плотности, поэтому в морях происходит более интенсивное вертикальное перемешивание воды.
В качестве первых санитарно – гигиенических характеристик пресной воды использовались органолептические показатели, которые были основаны на интенсивности восприятия органами чувств физических свойств воды. В настоящее время в эту группу в качестве нормативных характеристик входят:
· Запах при 20оС и подогреве до 60оС,
· балл Цветность по шкале, градус
· Прозрачность по шкале,
· Мутность по стандартной шкале, мг/дм3
· Окраска окрашенного столбца (отсутствие водных организмов и пленки)
В артезианских водах содержатся взвешенные твердые примеси. Они состоят из частиц глины, песка, ила, суспендированных органических и неорганических веществ, планктона и различных микроорганизмов. Взвешенные частицы влияют на прозрачность воды. Содержание в воде взвешенных примесей, измеряемое в мг/л, дает представление о загрязненности воды частицами в основном условным диаметром более 1·10-4 мм. При содержании в воде взвешенных веществ менее 2–3 мг/л или
больше указанных значений, но условный диаметр частиц меньше 1 · 10-4 мм, определение загрязненности воды производят косвенно по мутности воды. [2]
Требования предъявляемые к природной воде
Основными требованиями, предъявляемыми к питьевой воде, являются безопасность в эпидемическом отношении, безвредность по токсикологическим показателям, хорошие органолептические показатели и пригодность для хозяйственных нужд. Оптимальная температура воды для питьевых целей находится в пределах 7-11 °С. Наиболее близки к этим условиям воды подземных источников, которые отличаются постоянством температуры. Их в первую очередь рекомендуется использовать для хозяйственно-питьевого водоснабжения.
Органолептические показатели (мутность, прозрачность, цветность, запахи и привкусы) воды, потребляемой для хозяйственно-питьевых целей, определяются веществами, встречающимися в природных водах, добавляемыми в процессе обработки воды в виде реагентов и появляющимися в результате бытового, промышленного и сельскохозяйственного загрязнения водоисточников. К химическим веществам, влияющим на органолептические показатели воды, кроме нерастворимых примесей и гуминовых веществ относятся встречающиеся в природных водах или добавляемые в них при обработке хлориды, сульфаты, железо, марганец, медь, цинк, алюминий, гекса- мета- и триполифосфат, соли кальция и магния.
Водородный показатель рН большинства природных вод близок к 7. Постоянство рН воды имеет большое значение для нормального протекания в ней биологических и физико-химических процессов, приводящих к самоочищению. Для воды хозяйственно-питьевого назначения он должен находиться в пределах 6,5-8,5.
Количество сухого остатка характеризует степень минерализации природных вод; оно не должно превышать 1000 мг/л и лишь в отдельных случаях допускается 1500 мг/л.
Общая норма жесткости - 7 мг * экв/л.
В подземных водах, не подвергаемых обезжелезиванию, может быть допущено содержание железа 1 мг/л.
Азотсодержащие вещества (аммиак, нитриты и нитраты) образуются в воде в результате протекания химических процессов и гниения растительных остатков, а также за счет разложения белковых соединений, попадающих почти всегда со сточными бытовыми водами, конечным продуктом распада белковых веществ является аммиак. Присутствие в воде аммиака растительного или минерального происхождения не опасно в санитарном отношении. Воды, причиной образования аммиака в которых является разложение белковых веществ, непригодны для питья. Пригодной для питьевых целей считается вода, содержащая лишь следы аммиака и нитритов, а по стандарту допускается содержание не более 10 мг/л нитратов.
Сероводород может содержаться в природных водах в небольших количествах. Он придает воде неприятный запах, вызывает развитие серобактерий и интенсифицирует процесс коррозии металлов.
Токсические вещества (бериллий, молибден, мышьяк, селен, стронций и др.), а также радиоактивные вещества (уран, радий и стронцнй-90) попадают в воду с промышленными стоками и в результате длительного соприкосновения воды с пластами почвы, содержащими соответствующие минеральные соли. При наличии в воде нескольких токсических или радиоактивных веществ сумма концентраций или излучений, выраженная в долях концентраций, допустимых для каждого из них в отдельности, не должна превышать единицу. [3]
Жёсткая и мягкая вода
Вода с большим содержанием солей называется жёсткой, с малым содержанием — мягкой. Термин «жёсткая» по отношению к воде исторически сложился из-за свойств тканей после их стирки с использованием мыла на основе жирных кислот — ткань, постиранная в жёсткой воде, более жёсткая на ощупь. Этот феномен объясняется, с одной стороны, сорбцией тканью кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки на макроуровне. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне. Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2, и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний. Вкус природной питьевой воды, например, воды родников, обусловлен именно присутствием солей жёсткости.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда. [4]
Методики анализов
Определение общей жесткости.
Метод основан на образовании прочного комплексного соединения трилона Б с ионами кальция и магния.
Определение проводят титрованием пробы трилоном Б при рН 10 в присутствии индикатора.
1. Методы отбора проб
1.1. Пробы воды отбирают по ГОСТ 2874 и ГОСТ 4979.
1.2. Объем пробы воды для определения общей жесткости должен быть не менее 250 см3.
1.3. Если определение жесткости не может быть проведено в день отбора пробы, то отмеренный объем воды, разбавленный дистиллированной водой 1:1, допускается оставлять для определения до следующего дня.
Пробы воды, предназначенные для определения общей жесткости, не консервируют.
2. Аппаратура, материалы и реактивы.
Посуда мерная лабораторная стеклянная по ГОСТ 1770 вместимостью: пипетки 10, 25, 50 и 100 см3 без делений; бюретка 25 см3.
Колбы конические по ГОСТ 25336 вместимостью 250-300 см3.
Капельница по ГОСТ 25336.
Трилон Б (комплексон III, двунатриевая соль этилендиаминтетрауксусной кислоты) по ГОСТ 10652.
Аммоний хлористый по ГОСТ 3773.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Гидроксиламин солянокислый по ГОСТ 5456.
Кислота лимонная по ГОСТ 3118.
Натрий сернистый (сульфид натрия) по ГОСТ 2053.
Натрий хлористый по ГОСТ 4233.
Спирт этиловый ректификованный по ГОСТ 5962.
Цинк металлический гранулированный.
Магний сернокислый - фиксанал.
Хромоген черный специальный ЕТ-00 (индикатор).
Хром темно-синий кислотный (индикатор).
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.)
3. Подготовка к анализу.
3.1. Дистиллированная вода, перегнанная дважды в стеклянном приборе, используется для разбавления проб воды.
3.2. Приготовление 0,05 н. раствора трилона Б.
9,31 г трилона Б растворяют в дистиллированной и доводят до 1 дм3. Если раствор мутный, то его фильтруют. Раствор устойчив в течение нескольких месяцев.
3.3. Приготовление буферного раствора.
10 г хлористого аммония (NH4Cl) растворяют в дистиллированной воде, добавляют 50 см3 25 %-ного раствора аммиака и доводят до 500 см3 дистиллированной водой. Во избежание потери аммиака раствор следует хранить в плотно закрытой склянке.
3.4. Приготовление индикаторов.
0,5 г индикатора растворяют в 20 см3 буферного раствора и доводят до 100 см3 этиловым спиртом. Раствор индикатора хрома темно-синего может сохраняться длительное время без изменения. Раствор индикатора хромогена черного устойчив в течение 10 сут. Допускается пользоваться сухим индикатором. Для этого 0,25 г индикатора смешивают с 50 г сухого хлористого натрия, предварительно тщательно растертого в ступке.
3.5. Приготовление раствора сернистого натрия.
5 г сернистого натрия Na2S ∙ 9H2O или 3,7 г Na2S ∙ 5H2O растворяют в 100 см3 дистиллированной воды. Раствор хранят в склянке с резиновой пробкой.
3.6. Приготовление раствора солянокислого гидроксиламина.
1 г солянокислого гидроксиламина NH2OH ∙ HCl растворяют в дистиллированной воде и доводят до 100 см3.
3.7. Приготовление 0,1 н. раствора хлористого цинка.
Точную навеску гранулированного цинка 3,269 г растворяют в 30 см3 соляной кислоты, разбавленной 1:1. Затем доводят объем в мерной колбе дистиллированной водой до 1 дм3. Получают точный 0,1 н. раствор. Разведением этого раствора вдвое получают 0,05 н. раствор. Если навеска неточная (больше или меньше чем 3,269), то рассчитывают количество кубических сантиметров исходного раствора цинка для приготовления точного 0,05 н. раствора, который должен содержать 1,6345 г цинка в 1 дм3.
3.8. Приготовление 0,05 н. раствора сернокислого магния.
Раствор готовят из фиксанала, прилагаемого к набору реактивов для определения жесткости воды и рассчитанного на приготовление 1 дм3 0,01 н раствора. Для получения 0,05 н. раствора содержимое ампулы растворяют в дистиллированной воде и доводят объем раствора в мерной колбе до 200 см3.
3.9. Установка поправочного коэффициента к нормальности раствора трилона Б.
В коническую колбу вносят 10 см3 0,05 н. раствора хлористого цинка или 10 см3 0,05 н. раствора сернокислого магния и разбавляют дистиллированной водой до 100 см3. Прибавляют 5 см3 буферного раствора, 5-7 капель индикатора и титруют при сильном взбалтывании раствором трилона Б до изменения окраски в эквивалентной точке. Окраска должна быть синей с фиолетовым оттенком при прибавлении индикатора хрома темно-синего и синей с зеленоватым оттенком при прибавлении индикатора хромогена черного.
Титрование следует проводить на фоне контрольной пробы, которой может быть слегка перетитрованная проба.
Поправочный коэффициент (К) к нормальности раствора трилона Б вычисляют по формуле:
 ,
,
где v - количество раствора трилона Б, израсходованное на титрование, см3. [5]
Проведение анализа
6.1. Определение карбонатной (временной) жесткости воды
Временная жесткость воды обусловлена присутствием в растворе бикарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Эти соли титруются соляной кислотой по схеме:
HCO3- + H+ → H2CO3 → H2O + CO2 ↑
Реагенты:
1. Соляная кислота, HCl, раствор с точно установленной концентрацией
2. Индикатор метиловый оранжевый, 0,1%-ный водный раствор
Выполнение работы:
Пипеткой ёмкостью 50 или 100 мл вносят в коническую колбу исследуемую воду, прибавляют к ней две-три капли метилового оранжевого и оттитровывают стандартным раствором соляной кислоты. Титрование повторяют 2-3 раза и определяют объём HCl, пошедший на титрование воды:
ВЖВ =  , ммоль-экв/л
, ммоль-экв/л
Где V – объём пробы воды, взятой для титрования, мл.
Результаты титрования:
· V1 = 3,8 мл
· V2 = 3,9 мл
· V3 = 3,8 мл
Vср = 3,83 мл
ВЖВ = 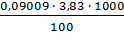 = 3,45 [6]
= 3,45 [6]
6.2. Определение общей жесткости воды
Метод определения кальция и магния при совместном присутствии заключается в том, что одну порцию раствора титруют в присутствии эриохрома черного Т. При этом оттитровывают кальций и магний. Другую порцию раствора титруют с мурексидом. Мурексид является индикатором и на кальций и на магний, но если перед титрованием ввести в титруемый раствор едкий натр, то магний осаждается в виде гидроксида и не титруется ЭДТА, титруется только кальций. Количество магния определяют по разности титрования суммы кальция и магния в присутствии эриохрома черного Т и титрования гидроксида кальция в присутствии мурексида.
Реагенты:
1. Комплексон III, Na2H2Y∙2H2O, 0,0500 н. раствор
2. Аммиачная буферная смесь с pH 10 (67 г NH4Cl и 570 мл 25%-ного NH3 в 1 л раствора).
3. Натрий гидроксид, NaOH, 2 M раствор.
4. Эриохром черный Т (ЭХЧ-Т), смесь с NaCl в соотношении 1:200.
5. Мурексид, смесь с NaCl в соотношении 1:200
Выполнение работы:
1. Отбирают пипеткой 50 мл исследуемой воды и переносят в коническую колбу, прибавляют 15 мл аммиачного буфера, перемешивают раствор и прибавляют на кончике ложечки около 0,05 г индикатора ЭХЧ-Т. Раствор перемешивают и титруют 0,05 н. раствором комплексона III до перехода красной окраски в синюю. Записывают значение V1, соответствующее объему комплексона III, пошедшего на титрование пробы воды.
Жесткость воды рассчитывают по формуле:
ЖВ =  , ммоль-экв/л
, ммоль-экв/л
где Vал – объем аликвоты, взятой для титрования, мл.
2. Отбирают пипеткой 50 мл исследуемого раствора, добавляют 2-3 мл NaOH, мурексид на кончике ложечки до окрашивания раствора в розовый цвет и титруют раствором комплексона III до изменения розовой окраски раствора в сине-фиолетовую. Записывают значение V2. Полученные данные используют для рассчета количества Ca2+ в пробе. Разность V2-V1 можно использовать для определения количества магния в растворе. [7]
Результаты титрования:
| 1) V11 = 5,2 мл | 2) V21 = 2,4 мл |
| V12 = 5,3 мл | V22 = 2,4 мл |
| V13 = 4,7 мл | V23 = 2,4 мл |
V1ср = 5,067 мл
V2ср = 2,4 мл
ЖВ = 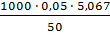 = 5,067 ммоль-экв/л
= 5,067 ммоль-экв/л
Ca2+:
V(Mg2+) = V3i = V1i – V2i
V21 = V22 = V23 = 2,4 мл
m(Ca2+) =  =
=  = 96,19 мг-экв/л
= 96,19 мг-экв/л
Mg2+:
V(Mg2+) = V3i = V1i – V2i
V31 = V11 – V21 = 5,2 – 2,4 = 2,8 мл
V32 = V12 – V22 = 5,3 – 2,4 = 2,9 мл
V32 = V13 – V23 = 4,7 – 2,4 = 2,3 мл
V3ср = 2,67 мл
m(Mg2+) =  =
= 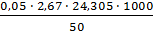 = 64,89 мг-экв/л
= 64,89 мг-экв/л
Вывод
Жесткость водопроводной воды в г. Ростове-на-Дону превышает предельно допустимый уровень более чем в 5 раз.
Список использованной литературы
1. Кострикин Ю.М., Мещерский Н.А., Коровина О.В., «Водоподготовка и водный режим энергообъектов низкого и среднего давления», справочник, 1990, Москва, Шлюзовая наб., 10, Энергоатомиздат, с. 7−9.
2. Кострикин Ю.М., Мещерский Н.А., Коровина О.В., «Водоподготовка и водный режим энергообъектов низкого и среднего давления», справочник, 1990, Москва, Шлюзовая наб., 10, Энергоатомиздат, с 9−12.
3. Химическая энциклопедия под редакцией Кнунянц И.Л., Издательство «Советская энциклопедия», 1990, Москва, Покровский бульвар, 8., Т. 2. с. 145.
4. www.wikipedia.org
5. ГОСТ 4151-72 Вода питьевая. Метод определения общей жесткости
6. Садименко Л.П., Методическое пособие к практическим занятиям по аналитической химии (Количественный анализ, часть II), 1999, Ростов-на-Дону, с. 16.
7. Садименко Л.П., Методическое пособие к практическим занятиям по аналитической химии (Количественный анализ, часть III), 1999, Ростов-на-Дону, с. 32-34.
Дневник учебной практики:
1. Фамилия: Дмитриев
2. Имя: Дмитрий
3. Отчество: Олегович
4. Ответственный за учебную практику на кафедре: к.х.н. Тягливый А.С.
5. Срок практики по учебному плану: с 9.02.17 по 25.05.17
| Сроки выполнения | Содержание работы |
| 09.02.17 | Выбор темы курсовой работы |
| 16.02.17 | Поиск литературы по теме «Анализ воды» |
| 23.02.17 | Поиск литературы по теме «Требования предъявляемые к природной воде» |
| 02.03.17 | Поиск литературы по теме «Временная жесткость воды» |
| 09.03.17 | Поиск литературы по теме «Постоянная жесткость воды» |
| 16.03.17 | Изучение методик анализа временной жесткости воды |
| 23.03.17 | Выбор методики анализа временной жесткости воды |
| 30.03.17 | Изучение методик анализа постоянной жесткости воды |
| 06.04.17 | Выбор методики анализа постоянной жесткости воды |
| 13.04.17 | Подготовка реактивов для проведения анализа временной жесткости воды |
| 20.04.17 | Проведение анализа временной жесткости воды |
| 27.04.17 | Подготовка реактивов для проведения анализа постоянной жесткости воды |
| 04.05.17 | Проведение анализа постоянной жесткости воды |
| 11.05.17 | Проведение расчетов |
| 18.05.17 | Выводы на основе расчетов |
| 25.05.17 | Оформление курсовой работы |