Практическая работа № 18
Тема: Решение термохимических задач (тепловой эффект реакции)
Вид учебного занятия: практическая работа
Цель: формирование умения решать термохимические задачи на тепловой эффект химической реакции.
Задание: решить задачи и ответить на контрольные вопросы (для решения задач в приложении представлены стандартные термодинамические величины)
Теоретические основы
Пример 1. Сколько выделится теплоты при получении 1 кг железа по реакции
Fe2O3(к)+3СО(г)=2Fe(к)+3СО2(г), если энтальпии образования Fe2O3(к), СО(г) и СО2(г) соответственно равны (кДж/моль): -822,7; -110,6 и -394,0.
Решение
1.Вычисляем тепловой эффект реакции (DH), используя следствие из закона Гесса.
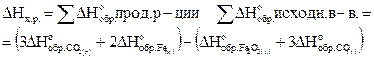
Так как энтальпия образования простого вещества принимается равной нулю то, 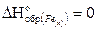 .
.
Тогда
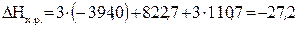 кДж
кДж
1. Проведем расчет по термохимическому уравнению:
если образуется 2×56г Fe, то выделяется 27,2 кДж;
если образуется 1000г Fe, то выделяется х кДж.
Решаем пропорцию и получаем
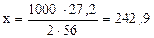 кДж, т.е.
кДж, т.е.
выделится 242,9 кДж теплоты.
Пример 2. Реакция горения этана выражается термохимическим уравнением
C2H6(г) + 3½O2 = 2 CO2(г) + 3H2O (ж); ΔHх.р. = -1559,87 кДж. Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж)
Решение.
Исходя из следующих данных:
а) С2Н6(г) + 3 ½О2(г) = 2СО2(г) + 3Н2О(ж); ΔН = -1559,87 кДж
б) С (графит) + О2(г) = СО2(г); ΔН = -393,51 кДж
в) Н2(г) + ½О2 = Н2О(ж); ΔН = -285,84 кДж
На основании закона Гесса
С2Н6 = 3 ½О2 – 2С – 2О2 – 3Н2 – 3/2О2 = 2СО2 + 3Н2О – 2СО2 – 3Н2О
ΔН = -1559,87 – 2(-393,51) – 3(-285,84) = +84,67 к Дж;
ΔН = -1559,87 + 787,02 + 857,52; С2Н2 = 2С + 3Н2;
ΔН = +84,67 кДж
Следовательно
∆Hобр С2Н6= -84,67 кДж
Пример 3. Реакция горения этилового спирта выражается термохимическим уравнением:
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж); ΔН =?
Вычислите тепловой эффект реакции, если известно, что мольная (молярная) теплота парообразования С2Н5ОН(ж) равна +42,36 кДж и известны теплоты образования: С2Н5ОН(г); СО2(г); Н2О(ж).
Решение. Для определения ΔН реакции необходимо знать теплоту образования С2Н5ОН(ж). Последнюю находим из данных:
С2Н5ОН(ж) = С2Н5ОН(г); ΔН = + 42,36 кДж.
+42,36 = -235,31 – ∆HC2H5OH(ж);
∆HC2H5OH(ж) = -235,31 – 42,36 = -277,67 кДж.
Вычисляем ΔН реакции, применяя следствия из закона Гесса:
ΔНх.р. = 2(-393,51) + 3(-285,84) + 277,67 = -1366,87 кДж.
Порядок выполнения практической работы
Решите следующие задачи
1.Сколько выделится теплоты при сжигании 1 кг алюминия, если 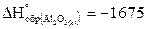 кДж/моль.
кДж/моль.
2. При сжигании какого количества магния выделяется 1000 кДж, если 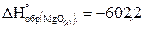 кДж/моль?
кДж/моль?
Контрольные вопросы:
1. Что называется тепловым эффектом химической реакции (DH)?
2. Перечислите факторы, влияющие на тепловой эффект химической реакции (DH).
3. Какие реакции называются экзотермическими и эндотермическими? Приведите примеры.
4. Какой знак имеет тепловой эффект (DH) для экзотермических и эндотермических реакций?
Сформулируйте вывод по работе
ПРИЛОЖЕНИЕ
СВЕДЕНИЯ ОБ ЭЛЕМЕНТАХ И ИХ СОЕДИНЕНИЯХ, НЕОБХОДИМЫЕ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Таблица 1 – Стандартные термодинамические характеристики некоторых веществ
| Вещество | 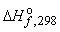 кДж/моль
кДж/моль
| 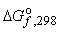 кДж/моль
кДж/моль
| S 0298 Дж/(моль·К) |
| Al2(SO4)3 (т) | –3444 | –3103 | |
| Al2O3 (т) | –1676 | –1580 | 50,9 |
| BaCO3 (т) | –1235 | –1134 | |
| BaO (т) | –548 | –518 | 70,4 |
| C (т) | 5,74 | ||
| C2H4 (г) | 219,4 | ||
| C2H5OH (ж) | –277 | –175 | 160,7 |
| CaCO3 (т) | –1207 | –1128 | |
| CaO (к) | –636 | –603 | |
| CaSiO3 (к) | –1562 | –1550 | |
| CH3OH (ж) | –239 | –166,2 | 126,8 |
| CH4 (г) | –74,85 | –50,79 | 186,19 |
| Cl2 (г) | 222,96 | ||
| CO(г) | –110,5 | –137,14 | 197,54 |
| CO2 (г) | –394 | –394,4 | |
| Fe (т) | 27,3 | ||
| Fe2O3 (т) | –823 | –740 | 87,9 |
| H2 (г) | |||
| H2O (г) | –242 | –229 | |
| H2O (ж) | –286 | –237 | |
| H2S (г) | –21 | –33,8 | |
| HСl (г) | –93 | –95,3 | |
| N2O (г) | |||
| Na2CO3 (т) | –1138 | –1048 | |
| Na2O (т) | –416 | –378 | 75,5 |
| NaOH (т) | –427,8 | –381,1 | 64,16 |
| NH3 (г) | –46 | –16,7 | |
| NH4Cl (т) | –314 | –203 | |
| NH4NO3 (т) | –365 | –184 | |
| NO (г) | 90,37 | 86,71 | 210,62 |
| NO2 (г) | 51,5 | 240,2 | |
| O2 (г) | |||
| P2O5 (т) | –1492 | –1348,8 | 114,5 |
| SiO2 (т) | –908,3 | –854,2 | 42,7 |
| SO2 (г) | –297 | –300 | |
| SO3 (г) | –395,2 | –370,4 | 256,23 |
| Zn (т) | 41,59 | ||
| ZnO (т) | –349 | –318,2 | 43,5 |
Стандартные теплоты (энтальпии) образования ΔHо298 некоторых веществ
| Вещество | Состояние | ΔHо298, кДж/моль | Вещество | Состояние | ΔHо298, кДж/моль |
| С2H2 | г | +226,75 | CO | г | -110,52 |
| CS2 | г | +115,28 | CH3OH | г | -201,17 |
| NO | г | +90,37 | C2H5OH | г | -235,31 |
| C6H6 | г | +82,93 | H2O | г | -241,83 |
| C2H4 | г | +52,28 | H2O | ж | -285,84 |
| H2S | г | -20,15 | NH4Cl | к | -315,39 |
| NH3 | г | -46,19 | CO2 | г | -393,51 |
| CH4 | г | -74,85 | Fe2O3 | к | -822,10 |
| C2H6 | г | -84,67 | Ca(OH)2 | к | -986,50 |
| HCl | г | -92,31 | Al2O3 | к | -1669,80 |