Химическая кинетика и равновесие
Химическая кинетика изучает скорость химической реакции, влияние различных факторов на скорость реакции и механизм реакции.
Различают истинную и среднюю скорости.
Скорость химической реакции- это количество вещества вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема или на единице поверхности раздела фаз.
 c
c
 |
∆t = t2 – t1
∆t → 0
 |
t1 t2 t
Различают гомогенную и гетерогенную скорости реакции.
|
n – количество вещества, моль
τ – время
v – объем данной фазы
s – поверхность раздела фаз
Гомогенная система состоит из одной фазы.
Гетерогенная система состоит из нескольких фаз.
Реакция в гомогенной системе протекает во всем объеме, в гетерогенной системе – на поверхности раздела фаз.
|

Когда скорость реакции определяют по образующимся продуктам реакции используют знак «+ », когда скорость определяют по исходным веществам, берется знак «- ». Таким образом, скорость реакции всегда величина положительная.
Cl2 (г) + 2 NO(г) → 2 NOCl (г) галогенид
нитрозила
υCl2 =  υNO =
υNO = 
υ NOCl = 
Чтобы скорости по отдельным веществам были равны, следует учитывать стехиометрические коэффициенты.
υ =  =
=  -
-  =
= 
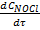
Зависимость скорости химической реакции от концентрации реагирующих веществ.
В основе зависимости скорости химической реакции от концентрации лежит закон действующих масс (1864-1867гг Гульдберг и Вааге). Скорость химической реакции при постоянной температуре в каждый момент времени пропорциональна произведению концентраций реагирующих веществ возведенных в некоторые степени – стехиометрические коэффициенты.
T = const aA + bB = cC + dD
|
n = a + b
|
n1, n2 - определяются экспериментально.
H2 + J2 = 2HJ ѵ = k 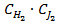
k- коэффициент пропорциональности, - называют удельной скоростью реакции или константой реакции.
 =
=  = 1 υ = k
= 1 υ = k
Зависимость скорости реакции от температуры
С увеличением температуры обычно увеличивается скорость. Правило Вант – Гоффа: повышение температуры на каждые 100 увеличивает скорость реакции в 2 – 4 раза

γ – температурный коэффициент скорости реакции
υT - скорость реакции при исходной температуре, Т
Kт - константа скорости реакции при исходной температуре
В широком интервале температур используют уравнение Аррениуса 
А- постоянная, Е –энергия активации.
е – основание натурального логарифма


 Активированный комплекс
Активированный комплекс
 | ||||||||
| ||||||||
| ||||||||
| ||||||||
 |
координата реакции
Энергетическая диаграмма протекания реакции
Энергия активации - минимальная энергия реагентов, достаточная для того, чтобы они вступили в химическую реакцию.
Катализ
Катализ – это изменение скорости химических реакций под действием веществ, количество и природа которых после завершения реакции останутся такими же, как и до реакции.
Катализатор - нерасходуемый реагент, увеличивающий скорость реакции.
Ингибиторы – препятствуют протеканию реакции
 | |||||
 | |||||
 | |||||


 Е
Е
Е`
 | |||
|
ээ
|
 |
Химическое равновесие
Такое состояние реакционной системы, когда скорость прямой реакции равна скорости обратной реакции.
aA + вВ ↔ сС + dD

 З.Д.М.
З.Д.М. 
 = const К=
= const К= 
Константа равновесия
H2 + J2 ↔2HJ
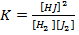 = 50,7
= 50,7
Смещение химического равновесия принцип Ле Шателье:
Если на систему находящуюся в состоянии равновесия, производится внешнее воздействие, то равновесие смещается в сторону той из двух противоположных реакций, которая ослабляет это воздействие.
 ∙
∙  ѵ гетер =
ѵ гетер =  ∙
∙ 


