Лабораторная работа № 1
Получение комплексных соединений
Краткие теоретические положения.
Соединения, в состав которых входят комплексные ионы, называются комплексными. Комплексные ионы состоят из центрального атома или иона, вокруг которого расположены другие ионы или полярные молекулы, способные к самостоятельному существованию в растворах и кристаллах. Центральный атом или ион называется комплексообразователем. Молекулы или ионы, расположенные около комплексообразователя, – лигандами. Число лигандов называется координационным числом комплексообразователя. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Остальные ионы, составляют внешнюю сферу комплексного соединения.
Например, комплексное соединение Fe(CN)3×3KCN следует изображать таким образом: K3[Fe(CN)6], где Fe3+ – комплексообразователь, ионы CN– – лиганды, [Fe(CN)6]3 – – внутренняя сфера комплекса, 3 К+ образуют внешнюю сферу комплекса.
Комплексные ионы кристаллогидратов часто окрашены. В этих случаях о разрушении и образовании комплекса можно судить по изменению окраски вещества.
В водных растворах комплексные соли, содержащие комплексный катион или анион, диссоциируют с образованием комплексных ионов, например:
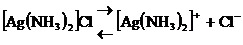
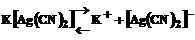 .
.
Диссоциация таких солей на катионы и анионы протекает почти полностью. Комплексные ионы, в свою очередь, подвергаются вторичной диссоциации:
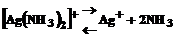 , (1)
, (1)
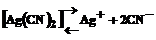 . (2)
. (2)
Диссоциация по такой схеме протекает в незначительной степени.
Применяя закон действия масс к равновесиям (1) и (2), получаем выражения констант неустойчивости комплексов:
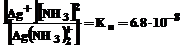 ,
,
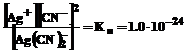 .
.
Константа неустойчивости комплекса характеризует прочность (устойчивость) внутренней сферы комплексного соединения. В приведенных примерах комплекс [Ag(CN)2 ] – более прочен, чем комплекс [Ag(NH3)2]+.
К комплексным соединениям относятся также и двойные соли, которые представляют собой соединения с малоустойчивой внутренней сферой. Обозначают их иначе, чем комплексные соединения, а именно как соединения молекул, например K2SO4×Al2(SO4)3. Принципиальной же разницы между двойными солями и комплексными соединениями нет. В растворе двойной соли имеется некоторое количество и комплексных ионов (в приведенном выше примере) [A1(SO4)2]–. Двойная соль отличается от комплексной соли лишь диссоциацией комплексного иона: у первой она практически полная, у второй – незначительная.
Двойные соли – довольно распространенные соединения. К ним относятся также соль Мора (NH4)2SO4×FeSO4×6H2O, двойной хлорид калия и меди 2КСl×СuС12×2Н2О и многие другие. Если, например, растворить в воде двойной хлорид калия и меди, то происходит диссоциация
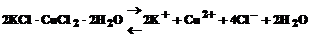
и все образовавшиеся в растворе ионы можно обнаружить с помощью соответствующих реакций. Но если это соединение рассматривать как комплексное, то его формулу надо изобразить как К2[СuС14]×2Н2О. Тогда диссоциацию К2[СuС14]×2Н2О можно записать уравнением
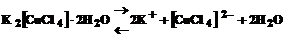 .
.
Образующийся комплексный ион [СuСl4]2– устойчив только в концентрированных растворах, и его константа неустойчивости при комнатной температуре выразится уравнением:
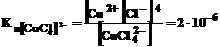 .
.
Сравнивая значение 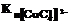 с константой нестойкости другого комплексного иона меди, например
с константой нестойкости другого комплексного иона меди, например 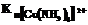 , равной 2×10–13, видно, что
, равной 2×10–13, видно, что 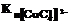 больше
больше 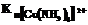 на несколько порядков, а чем меньше константа неустойчивости комплекса, тем больше его устойчивость.
на несколько порядков, а чем меньше константа неустойчивости комплекса, тем больше его устойчивость.
Цель работы: получить комплексные соединения; наблюдать изменения окраски при получении и разрушении комплексных соединений; изучить свойства двойных и комплексных солей.