Опыт 1. В пробирку возьмите кристаллик СоС12×6Н2О и осторожно нагрейте. Наблюдайте изменение цвета, соответствующее реакции
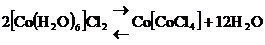
Комплекс [Со(Н2О)6]2+ окрашен в розовый цвет, а [СоС14]2– – в голубой.
Охладите пробирку и прибавьте несколько капель NaOH. Что образуется?
Опыт 2. Для ознакомления с комплексными соединениями серебра получите [Ag(NH3)2]Cl.
В коническую пробирку к одной капле раствора AgNO3 прибавьте 2 капли 2 н. раствора НС1 или NaCl. Отфильтруйте осадок, слейте фильтрат и к осадку прибавьте раствор NH4OH (лучше концентрированный) до полного растворения осадка. Напишите уравнения реакций.
Опыт 3. Так как диссоциация комплексного иона – процесс обратимый, то, уводя из сферы реакции, образуемые им ионы, можно практически разрушить комплекс. В качестве примера рассмотрите взаимодействие HNO3 с [Ag(NH3)2Cl].
[Ag(NH3)2]Cl полностью диссоциирует на [Ag(NH3)2]+ и С1–. Комплексный ион диссоциирует 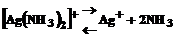 . Азотная кислота связывает молекулы аммиака
. Азотная кислота связывает молекулы аммиака 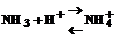 , уводя их из сферы действия, в результате чего новые ионы [Ag(NH3)2]+ подвергаются диссоциации (для восстановления равновесия), в растворе увеличивается концентрация Ag+. Теперь произведение концентраций свободных ионов Ag+ и имевшихся в растворе ионов С1– становится больше ПPAgCl и выпадает в осадок AgCl. Суммарный процесс можно записать так:
, уводя их из сферы действия, в результате чего новые ионы [Ag(NH3)2]+ подвергаются диссоциации (для восстановления равновесия), в растворе увеличивается концентрация Ag+. Теперь произведение концентраций свободных ионов Ag+ и имевшихся в растворе ионов С1– становится больше ПPAgCl и выпадает в осадок AgCl. Суммарный процесс можно записать так:
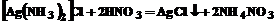
или
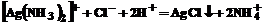 .
.
Убедитесь в сказанном на опыте. В пробирку с раствором [Ag(NH3)2]Cl прибавьте по каплям HNO3 (3-5 капель). Напишите уравнение реакции и объясните образование осадка при прибавлении HNO3.
Опыт 4. Практическое изучение свойств двойной и комплексной солей.
Возьмите 3 пробирки. В две пробирки поместите по 3 капли раствора аммониевожелезных квасцов NH4Fe(SO4)2×12H2O, а в третью – 3 капли раствора гексациано-II феррата калия K4[Fe(CN)6]. Затем в первую пробирку прибавьте 2 капли раствора хлористого бария, во вторую – 2-3 капли раствора NaOH (нагрейте до появления запаха аммиака), в третью – 2-3 капли раствора NaOH. Сопоставьте опыты в первых двух пробирках с опытом в последней пробирке. На какие ионы диссоциируют в водном растворе аммониевожелезные квасцы и гексациано-II феррат калия? Напишите уравнения диссоциации.
|
|
Опыт 5. Изучите комплексные соединения железа, в которых комплексом является анион.
В коническую пробирку внесите 2-4 капли свежеприготовленного раствора соли Мора и прибавьте равный объем раствора гексациано-III феррата калия K3[Fe(CN)6]. Содержимое пробирки разбавьте дистиллированной водой. Каков цвет осадка и как он называется? Напишите уравнение реакции.
Опыт 6. В коническую пробирку внесите 2-3 капли раствора FeCl3 и прибавьте 2–3 капли раствора гексациано-II феррата калия K4[Fe(CN)6]. Содержимое пробирки так же, как и в опыте 5, разбавьте водой. Каков цвет осадка и как он называется? Напишите уравнение реакции. Реактивами на какие ионы железа могут служить ионы [Fe(CN)6]3– и [Fe(CN)6]4–?
Опыт 7. Проведите синтез двойных и комплексных солей. Получите двойную соль сульфатов аммония и меди (NH4)2SO4×CuSO4×6H2Oили двойную соль сульфата калия и меди K2SO4×CuSO4×6H2O. Для этого 0.5 г пентагидрата сульфата меди растворите при нагревании в 1 см3 воды. Вычислите эквимолекулярное количество сульфата аммония (калия) и приготовьте насыщенный при 100°С раствор соли. Слейте горячие растворы сульфатов меди и аммония (калия), перемешайте стеклянной палочкой и поставьте кристаллизоваться при 0°С. Выпавшие кристаллы рассмотрите под микроскопом и сравните с кристаллами CuSO4×5H2O.
|
|
Определите, какие ионы находятся в растворе двойной соли. Для этого несколько кристаллов полученной соли растворите в воде и испытайте раствор на NH4+, K+ (действием Na3[Co(NO2)6]), Cu2+, SO42–.
Опыт 8. Получите двойную соль сульфатов аммония и никеля (NH4)2SO4×NiSO4×6H2O. Приготовьте два насыщенных при 80°С раствора, содержащих 0,7 г NiSO4×7H2O и 0,32 г (NН4)2SО4. Растворы слейте, перемешайте и охладите при 0°С. Выпавшие кристаллы рассмотрите под микроскопом и сравните с кристаллами NiSO4×7H2O.
Несколько кристаллов двойной соли растворите в воде и определите, какие ионы находятся в растворе (Ni2+ определите действием NaOH).
Опыт 9. Получите алюмоаммонийные квасцы (NH4)2SO4×Al2(SO4)3×24H2O.
Приготовьте два горячих раствора, содержащих 2,0 г сульфата алюминия в 2,0 см3 воды и 0,4 г сульфата аммония в 0,8 см3 воды. Растворы слейте, перемешайте и охладите до 6°С. Выдавшие кристаллы отделите от жидкости и высушите на фильтровальной бумаге. Полученную двойную соль взвесьте и вычислите выход в процентах. Часть кристаллов растворите в воде и определите, какие ионы находятся в растворе квасцов (А13+ определите действием NaOH).
Опыт 10. Получите сульфат тетраммин-меди II [Cu(NH3)4]SO4×Н2О.
6 г CuSO4×5H2O растворите в 10 см3 дистиллированной воды. Нагрейте раствор до кипения, затем при энергичном перемешивании стеклянной палочкой постепенно прибавляйте концентрированный раствор аммиака, пока не растворится выпавший вначале голубой осадок. К полученному раствору при перемешивании прибавляйте небольшими порциями 5 см3 этилового спирта. Выделившуюся соль отфильтруйте через воронку Бюхнера, высушите фильтровальной бумагой, взвесьте и высыпьте в банку с пробкой. Вычислите процент выхода комплексной соли от взятого CuSO4×5H2O.
|
|