Плотность растворов солей различной концентрации
| Плотность r, г/см3 | |||||||||
| ω(%) | NaCl | KCl | NH4Cl | CaCl2 | Na2SO4 | K2SO4 | MgSO4 | (NH4)2SO4 | Na2CO3 |
| 1,013 | 1,011 | 1,004 | 1,015 | 1,016 | 1,015 | 1,018 | 1,010 | 1,02 | |
| 1,027 | 1,024 | 1,011 | 1,032 | 1,035 | 1,031 | 1,039 | 1,022 | 1,04 | |
| 1,041 | 1,037 | 1,017 | 1,049 | 1,053 | 1,048 | 1,060 | 1,034 | 1,06 | |
| 1,056 | 1,050 | 1,023 | 1,066 | 1,072 | 1,065 | 1,082 | 1,046 | 1,08 | |
| 1,071 | 1,063 | 1,029 | 1,083 | 1,091 | 1,085 | 1,104 | 1,057 | 1,10 | |
| 1,086 | 1,077 | 1,034 | 1,101 | 1,111 | 1,126 | 1,069 | 1,12 | ||
| 1,101 | 1,090 | 1,040 | 1,120 | 1,131 | 1,148 | 1,081 | 1,15 | ||
| 1,116 | 1,104 | 1,046 | 1,139 | 1,151 | 1,172 | 1,092 | 1,17 | ||
| 1,132 | 1,118 | 1,051 | 1,158 | 1,196 | 1,104 | 1,20 | |||
| 1,148 | 1,133 | 1,057 | 1,177 | 1,220 | 1,115 | ||||
| 1,189 | 1,165 | 1,070 | 1,228 | 1,275 | 1,143 | ||||
| 1,282 | 1,172 | ||||||||
| 1,337 | 1,200 | ||||||||
| 1,396 | 1,228 |
Таблица 13
Стандартные окислительно-востановительные потенциалы в водных растворах
По отношению к нормальному водородному электроду
| Элемент | Реакция | Е0, В | Эле-мент | Реакция | Е0, В | ||
| Ag | Ag+ + e = Ag | 0,80 | B | H3BO3 + 3H+ + 3e = B + 3H2O | - 0,87 | ||
| AgBr + e = Ag + Br- | 0,55 | H2BO3- + H2O + 3e = B + 4OH- | - 1,79 | ||||
| AgCl + e = Ag + Cl- | 0,22 | Ba | Ba2+ + 2e = Ba | - 2,9 | |||
| Ag2CrO4 + 2e = 2Ag + CrO42- | 0,45 | Be | Be2+ + 2e = Be | - 1,85 | |||
| AgI + e = Ag + I- | - 0,15 | Be(OH)2 + 2H+ + 2e = Be + 2H2O | - 1,82 | ||||
| AgCH3COO + e = Ag + CH3COO- | 0,64 | BeO22- + 4H+ + 2e = Be + 2H2O | - 0,91 | ||||
| Ag2SO4 + 2e = 2Ag + SO42- | 0,65 | Bi | Bi3+ + 3e = Bi | 0,21 | |||
| Ag2CO3 +2e = 2Ag + CO32- | 0,45 | Br | Br2 + 2e = 2Br- | 1,09 | |||
| Ag(CN)2- + e = Ag + 2CN- | - 0,31 | Br3- + 3e = 3Br- | 1,05 | ||||
| AgCN + e = Ag + CN- | - 0,02 | 2HBrO + 2H+ + 2e = Br2 + 2H2O | 1,60 | ||||
| Ag2S + 2e = 2Ag + S2- | - 0,70 | 2BrO- + 2H2O + 2e = Br2 + 4OH- | 0,45 | ||||
| Al | Al3+ + 3e = Al | - 1,66 | HBrO + H+ + 2e = Br- + H2O | 1,34 | |||
| AlO2- + 2Н22О + 3e = Al + 4OH- | - 2,35 | BrO- + H2O + 2e = Br- + 2OH- | 0,76 | ||||
| Al(OH)3 + 3e = Al + 3OH- | - 2,31 | BrO3- + 5H+ + 4e = HBrO + 2H2O | 1,45 | ||||
| AlF63- + 3e = Al + 6F- | - 2,07 | BrO3- + 2H2O + 4e = BrO- + 4OH- | 0,54 | ||||
| As | HAsO2- + 3H+ + 3e = As + 2H2O | 0,25 | 2BrO3- + 12H+ + 10e = Br2 + 6H2O | 1,52 | |||
| H3AsO4 + 2H+ + 2e = HАsO2 + 2H2O | 0,56 | 2BrO3- + 6H2O + 10e = Br2 + 12OH- | 0,50 | ||||
| AsO2- + 2H2O + 3e = As + 4OH- | - 0,68 | BrO3- + 6H+ + 6e = Br- + 3H2O | 1,45 | ||||
| AsO43- + 2H2O + 2e = AsO2- + 4OH- | - 0,71 | BrO3- + 3H2O + 6e = Br- + 6OH- | 0,61 | ||||
| As + 3H+ + 3e = AsH2 | - 0,60 | C | HCHO + 2H+ + 2e = CH3OH | 0,19 | |||
| As + 3H2O + 3e = AsH3 + 3OH- | - 1,37 | HCOOH + 2H+ + 2e = HCOH | - 0,01 | ||||
| Au | Au3+ + 3e = Au | 1,50 | CH3CHO + 2H+ + 2e = C2H5OH | 0,19 | |||
| Au3+ + 2e = Au+ | 1,41 | CH3COOH + 2H+ + 2e = CH3CHO | - 0,12 | ||||
| Au+ + e = Au | 1,50 | CO2 + 2H+ + 2e = CO + H2O | - 0,12 | ||||
| AuCl4- + 3e = Au + 4Cl- | 1,00 | CO2 + 2H+ + 2e = HCOOH | - 0,20 | ||||
| AuBr4- + 3e = Au + 4Br- | 0,87 | 2CO2 + 2H+ + 2e = H2C2O4 | - 0,49 | ||||
| Ca | Ca2+ + 2e = Ca | - 2,87 | Cr | Cr3+ + 3e = Cr | - 0,74 | ||
| Cd | Cd2+ + 2e = Cd | - 0,40 | Cr3+ + e = Cr2+ | - 0,41 | |||
| CdS + 2e = Cd + S2- | - 1,17 | Cr2+ + 2e = Cr | 0,91 | ||||
| Ce | Ce3+ + 3e = Ce | - 2,40 | Cr(OH)3 + 2e = Cr + 2OH- | - 1,40 | |||
| Cl | Cl2 + 2e = 2Cl- | 1,36 | Cr(OH)3 + 3e = Cr + 3OH- | - 1,30 | |||
| 2HOCl + 2H+ + 2e = Cl2 + H2O | 1,63 | CrO42- +4H+ + 3e = CrO2- + 2H2O | 0,94 | ||||
| 2ClO- + 2H2O + 2e = Cl2 + 4OH- | 0,40 | CrO2- + 2H2O + 3e = Cr + 4OH- | - 1,20 | ||||
| HClO + H+ + 2e = Cl- + H2O | 1,50 | Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O | 1,33 | ||||
| ClO- + H2O + 2e = Cl- + 2OH- | 0,88 | CrO42- + 4H2O + 3e = Cr(OH)3 + 5OH- | - 0,13 | ||||
| HClO2 + 6H+ + 6e = Cl2 + 4H2O | 1,63 | Cr2+ + 2H2O + CrO2- + 4H+ | 1,19 | ||||
| HClO3 + 3H+ + 4e = Cl- + 2H2O | 1,56 | Cs | Cs+ + e = Cs | - 2,91 | |||
| ClO3- + 6H+ + 6e = Cl- + 3H2O | 1,45 | Cu | Cu2+ + 2e = Cu | 0,34 | |||
| ClO2- + H2O + 2e = ClO- + 2OH- | 0,66 | Cu+ + e = Cu | 0,52 | ||||
| ClO3- + H2O + 2e = ClO2- + 2OH- | 0,33 | Cu2+ + e = C+ | 1,53 | ||||
| 2ClO3- + 12H+ + 10e = Cl2 + 6H2O | 1,47 | Cu2+ +Br- + e = CuBr | 0,64 | ||||
| ClO3- + 3H2O + 6e = Cl- + 6OH- | 0,63 | Cu2+ + Cl- + e = CuCl | 0,54 | ||||
| ClO4- + 2H+ + 2e = ClO3- + 2H2O | 1,19 | CuCl + e = Cu + Cl- | 0,14 | ||||
| ClO4- + H2O + 2e = ClO3- + 2OH- | 0,36 | Cu2+ + I- + e = CuI | 0,86 | ||||
| 2ClO4- + 16H+ + 14e = Cl2 + 8H2O | 1,39 | CuBr + e = Cu + Br | 0,03 | ||||
| ClO4- + 8H+ + 8e = Cl- + 4H2O | 1,38 | CuI + e = Cu + I- | - 0,19 | ||||
| ClO4- + 4H2O + 8e = Cl- + 8OH- | 0,56 | Cu(NH3)42+ + e = Cu(NH3)2+ + 2NH3 | - 0,01 | ||||
| Co | Co3+ + e =Co2+ | 1,84 | Cu(OH)2 + 2e = Cu + 2OH- | - 0,22 | |||
| Co3+ + 3e =Co | 0,33 | Cu2O + H2O + 2e = 2Cu + 2OH- | - 0,36 | ||||
| Co2+ + 2e =Co | - 0,28 | Cu2S + 2e = 2Cu + S2- | - 0,54 | ||||
| Co(NH3)63+ ± e = Co(NH3)62+ | 0,10 | CuS + 2e = Cu + S2- | - 0,70 | ||||
| Co(OH)3 + e = Co(OH)2 + OH- | 0,17 | Cu(CN)2 + 2e = Cu + 2CN- | - 0,43 | ||||
| Co(OH)2 + 2e = Co + 2OH- | - 0,73 | F | F2 + 2e = 2F- | 2,87 | |||
| Fe | Fe3+ + e = Fe2+ | 0,77 | I | 2IO3- + 12H+ + 10e = I2 + 6OH- | 1,19 | ||
| Fe3+ + 3e = Fe | - 0,04 | 2IO3- + 6H2O + 10e = I2 + 12OH- | 0,21 | ||||
| Fe2+ + 2e = Fe | - 0,44 | IO3- + 6H+ + 6e = I- + 3H2O | 1,08 | ||||
| FeO42- + 6H+ + 3e ↔ Fe(OH)3 + 2H2O | 1,56 | IO3- + 3H2O + 6e = I- + 6OH- | 0,26 | ||||
| Fe(OH)3 + e = Fe(OH)2 + OH- | - 0,56 | IO4- + 2H2O + 2e = IO3- + 2OH- | - 0,68 | ||||
| FeS + 2e = Fe + S2- | - 0,98 | K | K+ + e = K | - 2,93 | |||
| FeO42- + 2H2O + 3e = FeO2- + 4OH- | 0,90 | Li | Li+ + e = Li | - 3,04 | |||
| FeO42- + 8H+ + 3e = Fe3+ + 4H2O | 1,90 | Mg | Mg2+ + 2e = Mg | - 2,37 | |||
| Ga | Ga3+ + 3e = Ga | - 0,56 | Mn | Mn2+ + 2e = Mn | - 1,19 | ||
| Ge | Ge2+ + 2e = Ge | Mn3+ + e = Mn2+ | 1,51 | ||||
| H | 2H+ + 2e = H2 | MnO2 + 4H+ + 2e = Mn2+ + 2H2O | 1,23 | ||||
| 2H+(10-7 M) + 2e = H2 | - 0,41 | MnO2 + 2H2O + 2e = Mn(OH)2 + 2OH- | - 0,0 | ||||
| H+ + e = H | - 2,1 | MnO42- + 4H+ + 2e = MnO2 + 2H2O | 2,26 | ||||
| H2 + 2e = 2H- | - 2,25 | MnO4- + e = Mn42- | 0,56 | ||||
| Hg | Hg2+ + 2e = Hg | 0,85 | MnO4- + 4H+ + 3e = MnO2 + 2H2O | 1,69 | |||
| Hg22+ + 2e = 2Hg | 0,79 | MnO4- + 2H2O + 3e = MnO2 + 4OH- | 0,60 | ||||
| 2Hg + 2e = Hg22+ | 0,91 | MnO4- + 8H+ + 5e = Mn2+ + 4H2O | 1,51 | ||||
| In | In3+ + 3e = In | - 0,33 | Mn(OH)3 + e = Mn(OH)2 + OH- | 0,1 | |||
| Ir | Ir3+ + 3e = Ir | 1,15 | N | N2 + 4H2O + 2e = NH2OH + 2OH- | - 3,04 | ||
| I | I2 +2e = 2I- | 0,54 | N2 + 4H2O + 4e = N2H4 + 4OH- | - 1,16 | |||
| I3- + 2e = 3I- | 0,55 | N2 + 8H+ + 6e = 2NH4+ | 0,26 | ||||
| 2HIO + 2H+ + 2e = I2 + 2H2O | 1,45 | N2 + 8H2O + 6e = 2NH4OH + 6OH- | - 0,76 | ||||
| 2IO- + H2O + 2e = I2 + 4OH- | 0,45 | NH2OH + 2H2O + 2e = NH4OH + 2OH- | 0,42 | ||||
| HIO + H+ + 2e = I- + H2O | 0,99 | HNO2 + H+ + e = NO + H2O | 0,90 | ||||
| IO- + H2O + 2e = I- + 2OH- | 0,49 | NO2- + H2O + e = NO + 2OH- | - 0,46 | ||||
| IO3- + 5H+ + 4e = HIO + 2H2O | 1,14 | 2HNO2 + 4H+ + 4e = N2O + 3H2O | 1,29 | ||||
| IO3- + 2H2O + 4e = IO- + 4OH- | 0,14 | 2HNO2 + 6H+ + 6e = N2 + 4H2O | 1,44 | ||||
| O | O3 + 2H+ + 2e = O2 + H2O | 2,07 | 2NO2‾ + 4H2O + 6e = N2 + 8OH- | 0,41 | |||
| O3 + H2O + 2e = O2 + 2OH- | 1,24 | HNO2 + 7H+ + 6e = NH4+ + 2H2O | 0,86 | ||||
| O2 + 4H+ + 4e = 2H2O | 1,23 | NO2- + 6H2O + 6e = NH4OH + 7OH- | 0,15 | ||||
| O2 + 4H+(10-7 M) + 4e = 2H2O | 0,82 | N2O + 2H+ + 2e = N2 + H2O | 1,77 | ||||
| O2 + 2H2O + 4e = 4OH- | 0,40 | N2O + H2O + 2e = N2 + 2OH- | 0,94 | ||||
| O2 + 2H+ + 2e = H2O2 | 0,68 | 2NO + 4H+ + 4e = N2 + 2H2O | 1,68 | ||||
| Os | Os2+ + 2e = Os | 0,85 | 2NO + 2H2O + 4e = N2 + 4OH- | 0,85 | |||
| P | P + 3H2O = 3e = PH3 + 3OH- | - 0,89 | NO3- + 3H+ + 2e = HNO2 + H2O | 0,94 | |||
| P + 3H+ + 3e = PH3 | 0,06 | NO3- + H2O + 2e = NO2- + 2OH- | 0,10 | ||||
| H3PO2 + H+ + e = P + 2H2O | - 0,51 | NO3- + 2H+ + e = NO2 + H2O | 0,80 | ||||
| H3PO3 + 2H+ + 2e = H3PO2 + H2O | - 0,50 | NO3- + H2O + e = NO2 + 2OH- | - 0,86 | ||||
| HPO32- + 2H2O + 2e = H3PO2- + 3OH- | - 1,57 | NO3- + 4H+ + 3e = NO + 2H2O | 0,96 | ||||
| Pb | Pb2+ + 2e = Pb | - 0,13 | NO3- + 2H2O + 3e = NO + 4OH- | - 0,14 | |||
| Pb4+ + 2e = Pb2+ | 1,80 | 2NO3- + 12H2O + 10e = N2 + 6H2O | 1,24 | ||||
| Pb4+ + 4e = Pb | 0,84 | NO3- + 10H+ + 8e = NH4+ + 3H2O | 0,87 | ||||
| PbO2 + 4H+ + 2e = Pb2+ + 2H2O | 1,46 | NO3- + 7H2O + 8e = NH4OH + 9OH- | - 0,12 | ||||
| PbO2 + 4H+ + SO42- + 2e = PbSO4 + 2H2O | 1,68 | Na | Na+ + e = Na | - 2,71 | |||
| PbO32- + H2O + 2e = PbO22- + 2OH- | 0,20 | Nb | Nb3+ + 3e = Nb | - 1,10 | |||
| PbO2 + H2O + 2e = Pb + 2OH- | 0,25 | Ni | Ni2+ + 2e = Ni | - 0,23 | |||
| PbO32- + 3H+ + 2e = HPbO2- + H2O | 1,55 | [Ni(CN)4]2- + e =Ni(CN)4]3-+CN− | <-0,4 | ||||
| Pd | Pd2+ + 2e = Pd | 0,987 | S | S + 2e = S2- | -0,476 | ||
| Pt | Pt2+ + 2e = Pt | 1,2 | S + 2H+ + 2e = H2S | 0,142 | |||
| Rh | Rh3+ + 3e = Rh | 0,8 | S4O62- + 2e = 2S2O32- | 0,219 | |||
| Te | Te + 2e = Te2- | -1,14 | SO42- + H2O + 2e = SO32- + 2OH- | -0,93 | |||
| Te + 2H+ + 2e = H2Te | -0,739 | 2SO42- + 10H+ + 8e = S2O32- + 5H2O | 0,29 | ||||
| Ti | Ti2+ + 2e = Ti | -1,63 | 2SO42- + 5H2O + 8e = S2O32- + 10H+ | -0,76 | |||
| Ti4+ + e = Ti3+ | -0,092 | SO42- + 8H+ + 6e = S + 4H2O | 0,357 | ||||
| Th | Th4+ + 4e = Th | -1,9 | 2SO42- + 4H+ + 2e = S2O42- + 2H2O | -0,22 | |||
| Tl | Tl+ + e = Tl | -0,336 | H2SO3 + 4H+ + 4e = S + 3H2O | 0,449 | |||
| Tl3+ + 2e = Tl+ | 1,26 | SO42- + 8H+ + 8e = S2- + 4H2O | 0,357 | ||||
| U | U3+ + 3e = U | -1,798 | SO42- + 10H+ + 8e = H2S + 4H2O | 0,303 | |||
| U4+ + e = U3+ | -0,607 | Se | Se3+ + 3e = Se | -2,08 | |||
| V | V2+ + 2e = V | -1,20 | Se + 2e = Se2- | -0,924 | |||
| V3+ + e = V2+ | -0,26 | Se3+ + 2H+ + 2e = H2Se | -0,399 | ||||
| VО2+ + 2H+ + e = V3+ + H2O | 0,34 | H2SeO3 + 4H+ + 4e = Se + 3H2O | 0,741 | ||||
| V2O5 + 6H+ + 2e = 2VO2+ + 3H2O | 0,96 | Sn | Sn2+ + 2e = Sn | -0,136 | |||
| Y | Y3+ + 3e = Y | -2,37 | Sn4+ + 2e = Sn2+ | 0,154 | |||
| Zn | Zn2+ + 2e = Zn | -0,76 | Sn4+ + 4e = Sn | 0,01 | |||
| Zn(OH)2 + 2e = Zn + 2OH- | -1,25 | HSnO2- + H2O + 2e = Sn + 3OH- | -0,91 | ||||
| ZnO22- + 2H2O + 2e = Zn + 4OH- | -1,22 | HSnO2- + 3H+ + 2e = Sn + 2H2O | 0,333 | ||||
| Zr | Zr4+ + 4e = Zr | -1,53 | Sr | Sr2+ + 2e = Sr | -2,89 | ||
Таблица 14
Русские, латинские названия и относительные атомные массы Ar некоторых химических элементов
| Символ элемента | Русское название | Латинское название | Ar, а.е.м. | Символ элемента | Русское название | Латинское название | Ar, а.е.м. |
| Ag Al As Au B Ba Be Br C Ca Cl Co Cr Cs Cu F Fe H Hg J K | серебро алюминий мышьяк золото бор барий берилий бром углерод кальций хлор кобальт хром цезий медь фтор железо водород ртуть йод калий | Argentum Aluminium Arsenicum Aurum Borum Barium Berillium Bromum Carboneum Calcium Chlorum Cobaltum Chronium Caesium Cuprum Fluorum Ferrum Hygrogenium Hydrargyrum Jodum Kalium | 107,86 26,968 74,902 106,977 10,811 137,327 9,012 79,904 12,011 40,078 35,453 58,933 51,996 132,915 63,546 18,998 55,847 1,008 200,59 126,904 39,098 | Mg Mn Mo N Na Ni O Pb Rb S Sb Se Si Sn Sr Te Ti U V W Zn | магний марганец молибден азот натрий никель кислород свинец рубидий сера сурьма селен кремний олово стронций теллур титан уран ванадий вольфрам цинк | Magnesium Manganum Molybdaeum Nitrogenium Natrium Niccolum Oxygenium Phosphorus Rubidium Sulfur Stibium Selenium Silicium Stannum Strontium Tellurium Titaniem Uranium Vanadium Wolframium Zincum | 24,305 54,938 95,94 14,007 22,990 58,69 15,999 207,2 85,468 32,066 121,75 78,96 28,086 118,710 87,62 127,60 47,88 238,029 50,942 183,85 65,39 |
Таблица 15
Основные классы органических соединений
| Углеводороды | |||||
| Непредельные | |||||
| Этиленовые | Ацетиленовые | Диеновые | Ароматические | ||
| Общая формула | CnH2n+2 | CnH2n | CnH2n-2 | CnH2n-2 | CnHn |
| Тип связи | 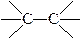
| 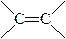
|

|
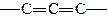
| |
| Окончание | АН | ЕН | ИН | ДИЕН | |
| Основные типы реаекций | 1..Замещениеводорода а) на галогены б) на нитрогруппу (реакция Коновалова) | 1. Присоединение а) водорода б) галогена в) галогеноводородов г) воды (для ацетиленовых это реакция Кучерова) 2. Окислениев присутствииН2О 3. Полимеризация | 1. Замещениеводорода а) на галоген б) на нитрогруппу 2. Присоединение а) водорода б) галогена |
 Схема образования эфиров
Схема образования эфиров
Окончание
| Спирты | Альдегиды | Кетоны | Карбоновые кислоты | Амины | |
| Общая формула | R – (OH)n | 
| 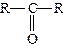
| R - COOH | R – NH2 |
| Тип связи | |||||
| Окончание | ОЛ | АЛЬ | ОН | ОВАЯ | АМИН |
| Основные типы реаекций | 1. Замещение а) водорода гидроксила на щелочной металл (алкоголята) б) всего гидроксила на галоген (с PCl5) в) всего гидроксила на аминогруппу 2. Окисление а) первичные спирты в альдегиды б) вторичные спирты в кетоны 3. Образование эфиров а) простых б) сложных 4. Для многоатомных спиртов с Cu(OH)2 5. Фенолы с NaOH |   1. Окисление
а) кислородом воздуха
б) Ag2O (реакция серебряного зеркала)
в) Cu(OH)2 1. Окисление
а) кислородом воздуха
б) Ag2O (реакция серебряного зеркала)
в) Cu(OH)2
 2. Замещениекислорода на галоген (с PCl5)
3. Присоединение 2. Замещениекислорода на галоген (с PCl5)
3. Присоединение
 а) водорода
б) HCN
в) NaHSO3
г) спирта
4. Полимеризация
5. Поликонденсация а) водорода
б) HCN
в) NaHSO3
г) спирта
4. Полимеризация
5. Поликонденсация
| 1. Диссоциация 2. Замещение а) водорода карбоксила на металл (соли) б) гидроксила карбокси ла на галоген (с PCl5) в) гидроксила карбоксила на аминогруппу (амиды) 3.Образование ангидридов 4. Образование сложных эфиров | 1. С Н2О (гидроксиды) 2. С кислотами(соли) |