Аммиачная вода -
Вода для охлаждения -
Пар -
Горячие топочные газы -
Раздел 2. Технологические и эксплуатационные характеристики процесса
2.1 Технологическая схема производства ЖКУ состава 10-34-0 из экстракиционной полифосфорной кислоты.
Предварительно подогретая полифосфорная кислота поступает в приемныйй сборник кислот 10, откуда через промежуточную емкость 15 при 700С непрерывно подается в трубчатый реактор 3 для нейтрализации газообразным аммиаком. Мольное отношение исходных компонентов NH3: Р2О5 = 2: 2,2. Аммиак поступает по центральному вводу реактора в количестве 60% от общего расходаю за счет тепла нейтрализации температура в реакторе повышается до 280-3200С, благодаря чему происходит дальнейшая дегидратация полифорной кислоты и степень конверсии Р2О5 увеличивается.
Образующийся плав полифосфатов аммония поступает в донейтрализатор 4, где растворятся в аммийачной воде и нейтралийзуется аммиаком до рН=6-7. Температуру в донейтрализаторе поддерживают в пределах 60-700С, за счет подачи охлаждающей воды в рубашку аппарата и непрерывной циркуляции раствора через холодильник 5. Из донейтрализатора выводят готовый раствор ЖКУ состава10-34-0. Его охлаждают в водном холодильнике до 25-300С и направляют на склад. Пары воды и непрореагировавший аммиак из донейтрализатора направляют в адсорбер 13 с плавающей кольцевой насадкой, орошаемой водой. Очищенные газы выбрасывают в атмосферу, а образующийся в абсорбере аммийачную воду подают в необходимом количестве в донейтрализатор на растворение плава. Для увеличения срока службы и надежности в эксплуатации реакторы, нейтрализаторы и теплообменники изготавливают из корозийонностойких марок стали, трубчатые реакторы изготавливают из сплавов марок 06ХН28 МДТ, «халстеллой» или углеграфита. Обоудование для хранения и транспортирования из углеродистой стали.
2.2Технологическая схема производства аммофоса.
Экстракционная фосфорная кислота концентрацией 25-28% Р2О5 и газообразный аммиак поступают в аппарат САИ (скоростной аммнизатор-испаритель) 1 при мольном отношении NН3:Н2РО3 =1:1. За счет теплоты нейтрализации темепература пульпы поднимается до 1000С и часть воды испаряется.
Затем аммофосная пульпа через промежуточные сборник 2, обогреваемй паром, подается в верхнюю часть аппарата РКСГ 3, где распыляется топочными газами, нагретыми до 7000С, поступающими из топки 4.
Пульпа упаривается и ее частицы опускаются в нижнюю часть аппарата, в которой топочными газами, поступающими из топки 5, создается кипящий слой. Здесь порошкообразный продукт гранулируется и высушивается. Высушенные гранулы поступают в холодильник кипящего слоя 6, в который подается воздух из холодильной установки 7, охлаждаемой жидким аммиаком.
Охлажденные гранулы аммофоса сортируются на грохоте 8. товарная продукция нужной дисперности поступает на склад, а крупная фракция измельчается в дробилке 9 и возвращается в холодильник 6. Фазы из аппарата РКСГ проходят через циклон 10, где отделяется пыль аммофоса, возвращаемая в аппарат, и поступает на абсорбцию аммиака и фтористого водорода в абсорбер 11, орошаемый водой.
2.3 Технологическая схема получения сложно-смешанных удобрении.
Производство сложно-смешанных удобрен ии можно получать различными схемами. В данной схеме представлена схема, где операции аммонизации и гранулирования осуществляются в одном аппарате -аммонизаторе-регулятое.
Исходные сухие калийные и фосфорные удобрения предварительно измельчают и смешивают в барабанном смесителе 3. Сюда же поступает ретур из бункера 1. Продолжительность смешения 2 минуты. Сухая смесь из смесителя 3 и жидкие продукты из емкостей 4 -плав аммиачной селитры или аммиакат, фосфорная и серная кислота - поступают в аммонизатор-гранулятор 9. Газообразный аммиак подают из испарителя 10 под слой гранулируемого материала.
В аммонизаторе-грануляторе протекают следующие химические реакции:
H3PO4 + NH3 = NH4H2PO4
Ca(H2PO4)2 · H2O + NH3 = CaHPO4 + NH4H2PO4 + H2O
NH4H2PO4 + CaSO4 + NH3 = CaHPO4 + (NH4)2SO4
KCl + NH4NO3 = KNO3 + NH4Cl
Аммонизация и гранулироание осуществляется в течении 8-10 минут. При аммонизации суперфрсфата поддерживают отношение NH3: H3PO4 = 1:3. За счет тепла реакции температура смеси в аппарате повышается до 65-750С, при этом испаряется 30-35% введенной воды. Полученные сырые гранулы поступают в сушильный барабан 12, где они высушивются горячими топочными газами при 3000С. Температура гранул на выходе из сушилки 70-800С, влажность 0,5%.
Сухой продукт классифицируют га грохоте 6. Крупные частицы измельчают в дробилке 8 и возвращают на россев. Мелкую фракцию возвращают в качестве ретура в аммонизатор-регулятор. Товарную фракцию (1-3 мм) охлаждают до 30-400С в аппарате 7 кипящего слоя, кондиционируют в барабане 13 и упаковывают. Отходящие газы очищают от пыли в циклонах, а от аммиака и фтора - полых башнях, орошаемых водой.
На 1 т сложно - смешанного удобрения состава 10,5 - 10,5 - 10,5 расходуется 0,54 т простого суперфосфата (19% Р2О5 ), 0,027 т серной кислоты 0,282 т 90%-ного плава аммиачной селитры, 0,023 т аммиака, 0,176 т хлорида калия (60% К2О).
2.1 Средства контроля и управление технологическим процессом производства аммофоса
Основными стадиями технологического процесса получения аммофоса из неупаренной кислоты являются: ступенчатая нейтрализация кислоты аммиаком последовательно до рН 3 и 5, выделение воды из аммофосной пульпы, гранулирование продукта, сушка гранул и их сортировка по размерам частиц.
Одним из способов получения аммофоса этой группы является применение продукта последовательно в горизонтальном смесителе и окаточном барабане с окончательным высушиванием продукта в барабанной сушилке. Эта схема призвана недостаточно удовлетворительной вследствие экстенсивности работы распылительной сушилки. Более совершенен способ с применением распылительно-кипящий сушилки-гранулятора (РКСГ). В этом аппарате совмещены процессы обезвоживания аммофосной пульпы и гранулирования аммофоса.
Для переработки неупаренной экстракиционной фосфорной кислоты разработан новый вариант производства аммофоса, включающие следующие операции: нейтрализация кислоты аммиаком в скоростном аммонизаторе-испарителе (САИ); выпаривание аммофосой пульпы в многокорпусной противоточной установке поверхностного типа с принудительной циркуляцией или в аппарате барботажно-скрубберного типа, сушка и гранулирование в барабанном грануляторе-сушилке (БГС), сортировка гранул, охлаждение товарного продукта воздухом в аппарате кипящего слоя (КС).
Концентрирование фосфорной кислоты выпариванием в методах других групп производств аммофоса предназначено не только для выделения воды, но и для обесфторивания кислоты. В процессе выпаривания может быть выделено до 80% газообразных соединении фтора. В одном из способов этой группы концентрирования фосфорнай кислота нейтрализируется газообразным аммиаком в две стадии: сначала в двух-трех сатураторах до рН 2,5-3,5, затем в барабанном аммонизаторе-грануляторе (АГ); в этом аппарате одновременно протекает процесс гранулирования с введением порошковидного ретурного аммофоса. За счет тепла нейтрализации здесь происходит частичная подсушка гранул аммофоса. Продукт окончательно высушивается в барабанной сушилке после чего гранулы сортируются и охлаждающей в аппарате КС.
Разработана также схема производства аммофосса, в которой вода, вводимая с экстракиционной фосфорной кислотой, удаляется выпариванием, а также за счет тепла реакции нейтрализации кислота аммиаком. Аммонизация кислоты происходит в трубчатом (струйном) реакторе под давлением, в котором протекает непрерывн ый процесс взаймодействия фосфортной кислоты с газообразным аммиаком. Реакция протекает с выделением тепла, поэтому температура аммофосной пульпы достигает 100-2000С. Пульпа из реактора вводится с помощью форсунки в закрытую башню, где давление снижается до атмосферного, в результате чего происходит самоиспарение воды за счет генерированного в пульпе тепла при этом подсушенный аммофос в виде мелкого порошка падает на дно башни. Пары воды вместе с газами и аммофосной пылью улавливаются водой в скруббере. Порошковидный аммофос гранулируется или используется для смешения с другими удобрениями.
На рисунке 1 представлена схема контроля производства аммофоса из упаренной фосфорной кислоты с применением аммонизатора-гранулятора.
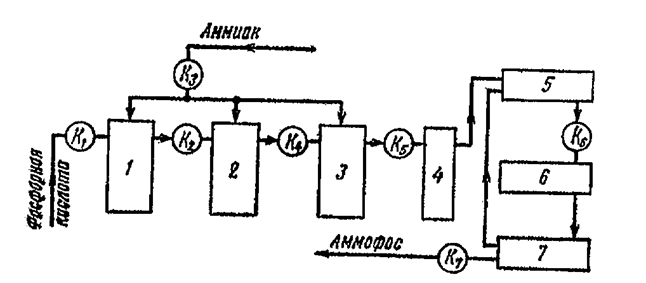
Рис.1. Основные точки контроля в производстве аммофоса:
1 - 3 — реакторы-сатураторы; 4 — промежуточные емкости; 5 — аммонизатор-гранулятор; 6 -барабанная сушилка; 7 — двухситный грохот; К1 - К7 — точки контроля;
Процесс начинается с каскада реакторов-сатураторов 1,2 и 3. Упаренная фосфорная кислота, содержащая 47-48% Р2О5, поступает в первый сатуратор, и в точке К1 в ней определяется содержанеи Р2О5. Аммиак, в жидком или газообразном состоянии, вводится в сатураторы 1 и 2 на расчетах нейтрализации кислоты на 80%, а в третий из расчетов образования 10-20% диаммонийфосфата. Концентрация аммиака контролируется в точке К3. В результате процесса нейтрализации пульпа нагревается до 115-1250С. В точках К2, К4 и К5 определяют-ся значения рН.
Пульпа из каскада реакторов-сатураторов поступает в промежуточную емкость 4, откуда насосом подается в аммонийзатор-гранулятор 5, где она смешивается с ретуром, масса которого в четыре раза превышает массу готового продукта. Влага поддерживается в пределах 2,5-3,5% и контролируется в точке К6. Средняя фракция после охлаждения идет на расфасовку, а крупная после измельчения и мелкая возвращается в смеситель-гранулятор как ретур. В точке К7 готовый продукт проверяют по ГОСТ.
В производстве аммофоса, как при производстве других сложных удобрении, особое значение имеет поддерживание заданного значения рН. На рисунке 2 представлена схема автоматического регулирования процесса нейтрализации в производстве аммофоса, основанная на поддержании заданного значения рН. По данной схеме нейтрализацию фосфорной кислоты аммиаком проводят в двух реакторах-сатураторах Р1 и Р2. На регуляторы соотношения потоков 5 воздействуют сигналы от блока умножения 2, преобразующего сигналы от расходомера 3 и от анализатора концентрации 1 (по плотности), расходомера аммиака 7 и одного из задатчиков 4. На задатчики поступают корректирующие сигналы от измерительных устройств 9 рН-метров 8. Под воздействием всех этих сигналов регуляторы соотношении потоков увеличиваю или уменьшают подачу аммиака с помощью регулирующих клапанов 6. Точность регулировании можно довести до рН+0,01. Если в реактор-сатуратор Р2 подавать более разбавленный раствор аммиака, тогда первый контур регулирования в реакторе Р1 будет осуществлять грубую компенсацию возмущений, а второй в реакторе Р2 более тонкую.
Аммофос, вследствие относительно высокого соедержания по отношению к азоту (отношение N: Р2О5 от 1:4,2 до 1:5,2) и отсутствия в своем составе калия, ограниченно применим как непосредственное удобрение. Более уравновешенные по содержанию азота, фосфора и калия сложные удобрения разных марок получают на основе фосфатов аммония добавлением азотного компонента-нитрата аммония и калийного компонента - хлорида или сульфата калия. Получаемые такм путем тройные сложные удобрения называются нитроаммофоска, двойные азотно-фосфорные, - нитроаммофос.Осваивается производство сложных удобрении на основе фосфатов аммония с добавлением азотного удобрения - карбамида. Они называются карбоамофоска и карбоаммофос.
Раздел 3. Расчетная часть
3.1Расчет материального баланса
Составить материальный баланс сатуратора для нейтрализации кислоты в производстве аммофоса (на 5000 кг фосфорной кислоты). Состав экстракиционной фосфорной кислоты: 25% Р2О5, 3,75% SO3, 3,6% MgO, 0,2% CaO, 1,3% Al2O3, 1,3% Fe2O3, 1,86% F. Состав жидкого аммиака: 99% NН3, 1% Н2О. В процессе насыщения кислоты аммиаком испаряется 390 кг воды на 5000 кг кислоты. Содержание аммиака в нейтрализованной пульпе 27% от общего количества Р2О5.
Решение.
П р и х о д
В приходные статьи баланса включается фосфорная кислота и аммиак.
В 5000 кг фосфорной кислоты (25% Р2О5) содержиться, кг:
5000∙0,25∙2∙98
 Н3РО4 = 1725,35
Н3РО4 = 1725,35
Н2О 5000 — 1725,35 = 3274,65
Количество расходуемого аммиака равно 27% от общего количества Р2О5, т.е.:
5000∙0,25∙0,27 = 337,5кг
С аммиаком поступает воды: (337,5∙1)/99 = 3,4 кг.
Р а с х о д
В результате обработки фосфорной кислоты аммиаком образуется пульпа и испаряется некоторое количество воды. Состав образующейся массы определяет-ся взаймодействием кислоты с содержащейся в ней примесями и аммиаком. В основу расчета количеств получаемых солей берем следующие стехиометричес-кие соотношения:
MgO + Н3РО4 + 2Н2О = MgНРО4 ∙ 3Н2О
СаО + Н3РО4 + Н2О = СаНРО4 ∙ 2Н2О
Al2O3 + 2Н3РО4 = 2AlРО4 + 3Н2О
Fe2O3 + 2Н3РО4 = 2 FeРО4 + 3Н2О
2NН3 + Н2SiF = (NH4)2SiF6
2NН3 + Н2SO4 = (NH4)2SO4
NН3 + Н3РО4 = NH4H2РО4
2NН3 + Н3РО4 = (NH4)2HРО4
При нейтрализации раствора фосфорной кислоты аммиаком в отделении сатурации получаются следующие соли, кг:
5000·0,036·174
димагнийфосфат = 783 
в том числе кристаллизационной воды —
5000·0,036·3·18
= 243 
5000·0,036·142
в том числе Р2О5 = 319,5 
40·2
[40, 174, 18, 142 - молекулярные массы MgO, MgНРО4 ∙ 3Н2О, Н2О и Р2О5]
5000·0,002·172
дикальцийфосфат = 30,7 
в том числе кристаллизационной воды —
5000·0,002·2·18
= 64,3 
5000∙0,002∙142
в том числе Р2О5 = 12,7 
56·2
[56 и 172 - молекулярные массы СаО и СаНРО4∙2Н2О]
5000·0,013·2·122
фосфат аллюминия = 155,5 
5000∙0,013∙142
в том числе Р2О5 = 90,5 
[102 и 122 - молекулярные массы Al2O3 и AlРО4]
5000·0,013·2·207
фосфат железа = 168 
5000∙0,013∙142
в том числе Р2О5 = 57,5 
[160 и 207 - молекулярные массы Fe2O3 и FeРО4]
5000·0,0186·178
кремнийфосфат аллюминия = 145 
6·19
5000∙0,0186∙2·17
в том числе NН3  = 27,5
= 27,5
6·19
[178, 17 и 19 - молекулярные массы (NH4)2SiF6, NН3 и молеклярная масса фтора]
5000·0,0375·132
сульфат аммония  = 309,4
= 309,4
5000∙0,0375∙2·17
в том числе NН3  = 79,5
= 79,5
[132 и 80 - молекулярные массы (NH4)2SO4 и SO3]
Количество Р2О5, связанной по первым четырем стехиометрическим соотношениям:
319,5 + 12,5 + 90,5 + 57,5 = 480 кг
Остальное количество Р2О5 связывается с аммиаком, образуя фосфаты аммония. Количество Р2О5, нейтрализуемого аммиаком:
5000·0,25 - 480 = 770 кг
Содержание аммиака в нейтрализованной пульпе составляет 27% от общего количества Р2О5. Израсходовано аммиака на образование кремнифторида и сульфата аммония:
27,5 + 79,5 = 107 кг
Следовательно, на образование фосфатов аммония пошло аммиака:
1250·0,27-107 = 230,5
Количество аммиака, необходимое для связывания всей Р2О5 (770 кг) в моноаммонийфосфат:
2·17·770
 = 184,4 кг
= 184,4 кг
Но при этом остается избыточного аммиака 230,5 - 184,4 = 46,1 кг, который идет на образование диаммонийфосфата. Его количество:
46,1·132
 = 178,9 кг
= 178,9 кг
2·17
Это количество требует моноаммонийфосфата
(178,9·115)/132 z ≈ 155,8
где 115 и 132 — молекулятные массы NH4HРО4 и (NH4)2HРО4
Так как из 770 кг Р2О5 могло образоваться мноаммонийнофосфата
(115·184,4)/17 = 1248
то после образования диаммонийфосфата остается моноаммонийфосфата:
1248 — 155,8 = 1092,2 кг
Выход сухих солей (с учетом кристаллизационной воды) составляет:
783 + 30,5 + 155,5 + 168 + 145 + 309,5 + 1092,2 + 178,9 = 2862,6 кг
в том числе воды кристаллизационной: 243 + 6,5 = 249,5 кг.
Выход сухих солей без кристаллизационной воды:
2862,6 - 249,5 = 2613 кг.
Приводим состав сухих с учетом кристаллизационной воды:
кг %
MgНРО4 3Н2О.......................................783 27,35
СаНРО4 ∙ 2Н2О......................................30,5 1,07
AlРО4 …............................................... 155,5 5,43
FeРО4..................................................... 168 5,87
(NH4)2SiF6.............................................. 145 5,07
(NH4)2SO4............................................. 309,5 10,81
NH4H2РО4..............................................178,9 6,24
(NH4)2HРО4..........................................1092,2 38,16

Всего.................. 2862,6 100
В систему поступает материалов (фосфорной кислоты, аммиака и воды с ним):
5000 + 337,5 + 3,4 = 5340,9
В процессе сатурации из систем испаряется 390 кг воды на 5000 кг кислоты. Количество пульпы после испарения воды равно:
5341- 390 = 4951 кг
В конечной пульпе содержиться свободной воды:
4951 - 2862,6 = 2088,4
Всего воды в пульпе:
2088,4 + 249,5 ≈ 2338 кг
Процентное содержание общей влаги в пульпе:
(2338·100)/ 4951 = 47,2%
Составляем материальный баланс сатурации в производстве аммофоса (на 5000 кг фосфорной кислоты):
Приход кг % Расход кг %
25%-ная по Р2О5 экс- солевая масса пульпы 2862,5 53,6
тракционная кислота в персчете на в то числе
моногидрат (100% Н3РО4).......................1725 32,30 MgНРО4·3Н2О 783
вода с фосфорной кислотой...................3275 61,32 СаНРО4 ∙ 2Н2О 30,5
аммиак..................................................... 337,5 6,32 AlРО4 155,5
вода с аммиаком.......................................3,5 0,06 FeРО4 168
(NH4)2SiF6 145
(NH4)2SO4 309,5
NH4H2РО4 178,5
(NH4)2HРО4 1092,5
вода в пульпе (свобод-
ная)............................2088,5 39,1
водяной пар........................390 7,3
 |
 Всего…................ 5341 100 Всего …..............5341 100
Всего…................ 5341 100 Всего …..............5341 100
3.2 Расчет теплового баланса
Ипользуя данные материального баланса, рассчитать тепловой баланс сатурации в производстве аммофоса на 5000 кг фосфорной кислоты указанного выше состава. Температуры: поступающей кислоты 600С, аммиака -270С, при давлении 152 кПа (1,5 атм), отходящей пульпы 1020С.
Решение
П р и х о д т е п л о т ы
Выделение теплоты за счет реакции, кДж:
образования моноаммонийфосфата —
Н3РО4 + NH3 = NH4H2PO4 + 75 362 кДЖ
(184,5·73 392)/17 = 817 900
[184,5 - количество (в кг) вступившего в реакцию аммиака]
образования диаммонийфосфата из моноаммонийфосфата —
NH4H2PO4 + NH3 = (NH4)H2PO4 + 96 296 кДж/кмоль
(46·96 296)/17 = 260 565
[46 - количество (в кг) аммиака, реагирующего с моноаммонийфосфатом]
Н2SO4 + NH3 = (NH4)2SO4 + 193 849 кДж/кмоль
(79,5·193 849)/(2·17) = 453 265
[79,5 - количество (в кг) аммиака, связываемого в сульфат]
Н2SiF6 + 2NH3 = (NH4)2SiF6 + 159 089 кДж/кмоль
(27,5·159 089)/(2·17) = 128 680
[27,5- количество (в кг) аммиака, вступившего в реакцию]
 Всего за счет химических реакции …..........................1 660 410
Всего за счет химических реакции …..........................1 660 410
(В расчете не включены из-за их малости тепловые эффекты других реакции).
Теплота, вносимая кислотой и аммиаком:
5000·2 868·60 + (-117,2·67,5) = 820 845 кДж
где 5000 - количество фосфорной кислоты, кг;
2 868 - средняя удельная теплоемкость кислоты, кДж/(кг·К);
60 - температура кислоты, 0С;
-117,2 - энтальпия аммиака при -270С и 152 кПа (1,5 атм), кДж/кг;
67,5 - количество аммиака, кг;
Всего поступает теплоты: 1 660 410 + 820 845 = 2 481 255кДж
Р а с х о д т е п л о т ы
Нагревание пульпы до 1020С:
5341·2 721·102 = 1 387 710 кДж
где 5341 - количество пульпы, кг;
2 721 - средняя удельная теплоемкость пульпы, кДж/(кг·К);
102 - температура пульпы, 0С;
Теплопотери в окружающую среду принимаем равными 3% от общего количества подводимой теплоты:
2 481 255 · 0,03 = 74 437,65 кДж
Всего расходуется теплоты: 1 387 710 + 74 437,65 = 1 462 147,6 кДж
Избыток теплоты расходуется на испарение воды: 2 481 255 - 1 462 147,6 ≈ 1 019 108 кДж.
Количество испаряющейся воды составит:
1 019 108/2 253 = 452,3 кг
где 2 253 - скрытая теплота испарения воды при 1020С, кДж/кг.
Общий расход теплоты: 1 387 710 + 74 437,65 + 1 019 108 = 2 481 255 к Дж
Составляем тепловой баланс сатурации фосфорной кислоты аммиаком (на 5000 кг фосфорной кислоты):
Приход кДж % Расход кДж %
теплота реакций обра- на нагревание
зования: пульпы........................1 387 710 35,93
NH4H2РО4 …...........817 900 32,96 на испарение воды.....1 019 105 41,07
(NH4)2HРО4 ….........260 565 10,50 теплопотери..................74 440 3,00
(NH4)2SO4 …............453 265 18,17
(NH4)2SiF6 …...........128 680 5,19
теплота, вносимая фосфорной
 кислотой и аммиаком....820 845 33,08
кислотой и аммиаком....820 845 33,08
 Всего..................2 481 255 100 Всего...................2 481 255 100
Всего..................2 481 255 100 Всего...................2 481 255 100
3.3 Расчет гранулятора-аммонизатора
Гранулятор-аммонизатор имеет длину L = 6 м и диаметр D = 4 м. Определить частоту вращения барабана и теоретическое время пребывания в нем материала, если степень заполнения гранулятора равна 0,2, а наклон его по отношению к горизонту составляет ά = 20.
Решение.
Частоту вращения барабана выбирают такой, при которой обеспечивается передвижение массы частиц вверх по стенке цилиндра, а затем ссыпание его вниз. Для этого скорость вращения барабана не должна превышать критическую п кр, когда под влиянием центробежной силы частицы прижимаются к поверхности барабана и не ссыпаются вниз.
Критическая скорость вращения барабана в 1 минуту определяется в зависимости от его диаметра по следующей формуле:
п кр = 42,3/√D
В зависимости от свойств материала фактическая скорость вращения п ф составляет разную долю от п кр. Для гранулирования сложных удобрении п ф должна быть ~ 35% от п кр
42,3 42,3·0,35

 п ф = · 0,35 = = 7,4 об/мин
п ф = · 0,35 = = 7,4 об/мин
√D √4
Теоретическое время пребывания материала в грануляторе (τт, мин) определяют по формуле:
mkL
 τт =
τт =
D n tg ά
где m — коэффициент, зависящий от отношения жидких и твердых веществ в грануляторе и гранулометрического состава продукта;
k — коэффициент, зависящий от устройства барабана (L, D, ά).
При степени заполнения барабана β = 0,2 (по перерабатываемому материалу без учета ретура) примем m = 1,0 и k = 2,04
1,0·2,0·6 12

 τт = = = 11,6 минут
τт = = = 11,6 минут
7,4·4· tg 2 7,4·4·0,035
На практике фактическое время пребывания материала в грануляторе в 1,3-1,8 раза больше вычисленного.
Раздел 5. Экологическая характеристика производства
При производстве минеральных удобрении особое значение имеет борьба с выбросами вредных веществ в атмосферу и водоемы.
На различных стадиях производств минеральных удобрении при проведе-нии ряда физико-химических и тепловых процессов в газовую фазу выделяются аммиак, оксиды азота, серы, углерода, фтористые соединения и т.п., с одной стороны представляющие собой ценные продукты, с другой - являющиеся источником загрязнении, а порой и отравления окружающей среды. Поэтому проблема улавливания, обезвреживания и утилизации ценных веществ, содержащихся в отходящих газах, сродни проблемам комплексного использования сырья и создания безотходных технологии.
Очистка от фтора. В процессах производства экстракиционной фосфортной кислоты, фосфорных, сложных, комплексных и др. удобрении образуются следующие соединения фтора: фторид водорода, тетрафторид кремния и гексафторкремниевая кислота.
В зависимости от содержания фтористых соединении и их свойства отходящие газы подразделяются на три группы:
1) чистые операционное отделение производства) - утилизируемые газы;
2) с примесями пыли или брызг(отделение сушки, реакционное отделение производства) - газы утилизируются после очистки от примесей;
3) загрязненные пылью, брызгами, парами кислот и другими примесями - нейтрализируемые газы;
Неутелизируемые газы характеризуются низким содержанием фтора (0,1-0,6 г/м3 ), который улавливают вместе с другимим примесями и пылью, водой или щелочными растворами с целью очитски отходящих газов до предельно допустимой концентрации (ПДК).
Водная абсорбция фтористых соединении практически сводится к поглощению туманообразной Н2SiF6 (гексафторкремниевая кислота). Физические Н2SiF6, степень ее выделения зависят от температуры и концентрации кислоты. Повышение температуры и концентрации приводит к образованию твердых отложений на внутренних поверхностях оборудовании.
Высокая степень абсорбции фтористых соединении достигается при условии промывки газа циркулирующим раствором Н2SiF6, имеющим ту же температуру, что и газ. Это приводит к предовращению конденсации воды и образовнию тумана.
На стадии санитарной очистки газов от фтористых соединении используют абсорбцию 0,5-3% гидроксидом кальция (известковым молоком):
2НF + Са(ОН)2 → СаF2 + 2Н2О
SiF4 + 2Са(ОН)2 → 2СаF2 + SiО2 + Н2О
Очистка от аммиака и оксидов азота. При производстве сложных удобрении приходиться очищать отходящие газы, содержащие также аммиак и оксиды азота. В производстве фосфатов аммония (аммофос), например, в газах, отходящих от грануляционно-сушильных агрегатов, кроме фтористых соединении содержащих аммиак. Они переходят в газовую фазу также при упаривании аммофосной пульпы; выделение фтора и аммиака в газовую фазу, правда, в небольших количествах, наблюдается и при нейтрализации фосфорной кислоты аммиаком.
Переход аммиака и фтора в газовую фазу происходит в основном при сушке пульпы влажных гранул аммофоса. При этом значительному разложению подвергается только диаммонийфосфат, отличающийся низкой термической стойкостью. Выход аммиака в газовую фазу существенно преобладает над выходом фтористых соединении. Естественно, при выборе системы очистки отходящих газов необходимо учитывать условия абсорбции как аммиака, так и фтористых соединении. Оксиды азота выделяются в газовую фазу при азотнокислом разложении фосфатов. В газовой фазе оксиды азота присутствуют обычно в виде NO, NO2, N2O3 и N2O4, причем NO не реагирует с водой, поэтому до абсорбции ему необходимо окислиться по реакции: 2NO + О2 = 2 NO2. Монооксид азота NO может также соединеняться с диоксидом NO2 с образованием N2O3, который при абсорции водой дает чистую азотную кислоту. Однако N2O3 присутствует в газах в заметных количествах лишь при низких температурах и высоких давлениях, поэтому его содержанием обычно принебрегают.
В качестве поглотителя аммиака, как правило применяют воду (вследствие его высокой растворимости в воде). При поглощении аммиака водой получается аммиачная вода, концентрация которой зависит от содержания аммиака в очищаемых газах и от темепературы абсорбции. Аммиачная вода может быть использована напосредственно в качестве целевого продукта, но при этом она долна содержать 20-25% NН3; при более низкой концентрации ее обычно используют в технологическом процессе.
При необходимости возвращения улавливаемого аммиака в процесс его иногда абсорбируют серной или фосфорной кислотой:
NН3 + Н3РО4 = NН4Н2РО4, 2NН3 + Н2SО4 = (NН4)2SО4,
Для концентрирования растворов фосфатов (или сульфатов) аммония с целью их возвращения в производство организуют рециркуляцию орошающих растворов.
Водная абсорбция диоксида азота (или N2O4) протекает по суммарной реакции:
3NO2 + Н2О = 2НNO3, или 3N2O4 + 2Н2О = 4НNO3 + 2NO
При этом поглощается лишь 2/3 введенного с NO2 азота, остальное количество поглощения должен быть окислен в газовой фазе. Таким образом, процесс абсорбции оксидов азота можно рассматривать как ряд последовательных стадии окисления и поглощегия.
Улавливание оксидов азота из отходящих газов проводят также растворами карбоната натрия (соды) или гидрооксида натрия (едкого натра), например:
Na2CO3 + NO + NO2 → NaNO3 + CO2,
Na2CO3 + 2NO2 →NaNO3 + CO2,
Образующийся растворы обрабатывают азотной кислотой для превращения нитрита натрия в нитрат, а затем путем выпаривания и кристаллизации извлекают из него нитрат натрия.
Очистка сточных вод.
Раздел 6. Охрана труда, техника безопасноти и противопожарная защита.
Вредными веществами в производстве комплексных удобрении являются неорганические кислоты, аммиак, пыль фосфата и готовых продуктов, фторосодержащие газы, оксиды азота.
Аммиак вызывает раздражение и ожоги слизистых облочек, дыхательных путей, кожного покрова. Предельно допустимая концентрация аммиака в воздухе производственных помешении 20 мг/м3. Аммиак образует с воздухом взрывоопасные смеси. Предельные взрывооасные концентрации аммиака в воздухе 15-27%.
Опасность представляет также аммиачная вода. Поскольку из аммиачной воды испаряется аммиак, для ее перевозки необходимы герметичные стальные или чугунные резервуары с предохранительными клапанами. Степень заполнения емкостей аммиачной водой должна быть не более 93%, так как при повышении температуры может сильно возрасти давление. После опорожнения цистерн в них остается взрывоопасная аммиачно-воздушная смесь. Поэтому при обслуживании и ремонте емкостей из-под аммиачной воды нужно соблюдать те же меры предосторожности, что и при обслуживании тары после легко воспламеняющихся жидкостей. При загорании аммиак можно тушить водой.
Для производства минеральных удобрении характерны многочиленные опреации, связанные с возможным выделением пыли: транспортирование, измельчение, рассев, сушка, охлаждение, кондиционирование, упаковка сыпучих материалов и продуктов. Для снижения засыпленности рабочих мест пылящее оборудование (размольные устройства, грохоты, транспортеры и др.) должны быть закрыты и иметь вентиляционные отсосы.
Во многих производствах минеральных удобрении применяются концентрированные кислоты — серная, азотная, фосфорная и др. Поэтому имеется опасность ожогов. Для предотвращения их следует работать в спецодежде. При разбавлении башенной или отработанной серной кислоты следует помнить о возможности выделения окислов азота, сернистого ангидрида или паров органических веществ (в зависимости от содержания примесей в отработанной кислоте).
В производстве минеральных удобрении опасность представляют многочисленные движущиеся механизмы, электрическое и механическое оборудование — насосы, компрессоры, фильтры, центрифуги, грохоты, размольные устройства, многочисленные транспортирующие устройства (транспортеры, элеваторы, шнеки) и др. Безопасная эксплуатация такого оборудования обеспечивается исправными ограждениями всех движущиеся частей. Для безопасного обслуживания шнеков, транспортеров и элеваторов запрещается на ходу производить их смазку, ремонт, а также надевать приводные ремни и натягивать транспортерные ленты. Чистку механического оборудования разрешается производить только после его остановки и снятия напряжения с электродвигателей. Преставляют опасность также аппараты, работающие под давлением и электрооборудование высокого напряжения.
При производстве комплексных удобрении необходимо соблюдать общие требования безопасности: работать в спецодежде, не принимать пищу, не пить и не курить на рабочем месте, принимать горячий душ после работы. Основными условием безопасной работы является тщательная герметизация оборудования и коммуникации, исправность вентиляционных устройств.
Основным условием безопасной эксплуатации производства является строгое соблюдение регламента и инструкции, исправность оборудования, хорошо работающая вентиляция, обеспечивающая допустимое содержание вредных веществ и пыли (что особенно важно для отделений, в которых возможны значительные выделения газов и пыли), нормальную температуру и влажность воздуха в отделениях с повышенным выделением влаги. Должны быть механизированны также трудоемкие процессы, как затаривание, взвешивание и зашивание мешков, транспортирование их на склад, погрузка готовой продукции в вагоны, подача топлива в топки сушильных барабанов, удаление золы и др.
Литература:
«Основные процессы технологии минеральных удобрении» - П.В.Классен, И.Г.Гришаев, Москва «Химия» 1990;
«Расчеты по технологии неорганических веществ» - М.Е.Прзин,
«Химия», 1977;