Водород.
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.

| Получение: 1.В промышленности: Конверсионный способ. Вначале получают водяной газ, пропуская пары воды через раскаленный кокс при 1000 °С: С + Н2О -tà СО + Н2. Затем оксид углерода (II) окисляют в оксид углерода (IV), пропуская смесь водяного газа с избытком паров воды над нагретым до 400–450 °С катализатором Fe2O3: CO +H2O = CO2 + H2. Окисление метана водяным паром: CH4 + 2Н2O –(t, Ni)à4Н2 + CO2 Термическое разложение метана при 1200 °С: CH4 -tà C + 2H2 Электролиз водного раствора поваренной соли или гидроксида натрия: (NaOH) + 2Н2O –эл.токà 2Н2 + O2 2NaCl + 2H2O –эл.токà H2 + Cl2 + 2NaOH; 2. В лаборатории: Zn + 2HCl à ZnCl2 + Н2 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2; Si + 2NaOH + H2O = Na2SiO3 + 2H2. | Свойства: 1.С металлами: Н2 + 2Na -tà2NaH Н2 + Са -tà СаН2 2. С неметаллами: 2Н2 + O2 à 2Н2O Н2 + Cl2 -hvà 2HCl 3Н2 + N2 -t, p, кат.à 2NH3 H2 + S à H2S 3. С оксидами металлов (неактивных) и неметаллов: CuO + H2 à Cu + H2O 2NO + 2H2 = N2 + 2H2O. |
Водородные соединения металлов и неметаллов.
1. Ионные гидриды: Получение: Н2 + 2Na -tà2NaH
Свойства: разлагаются водой и кислотами:
NaH + Н2O à NaOH + Н2
СаН2 + 2HCl à CaCl2 + 2Н2
2. Ковалентные водородные соединения:
Все газы, кроме воды (водородные связи).
| CH4- метан | NH3-аммиак | H2O - вода | HF –фтороводород |
| SiH4 - силан | PH3 - фосфин | H2S - сероводород | HCl - хлороводород |
Неустойчивые: фосфин и силан.
Основными свойствами обладает: аммиак.
Амфотерные свойства проявляет: вода.
Кислоты образуют в водном растворе: сероводород и галогеноводороды.
Вода.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те.
Свойства:
1. С металлами:
а) щелочные и щелочноземельные (кроме бериллия и магния): 2Na + 2Н2O = 2NaOH + Н2
б) остальные металлы в ряду активности до Н могут окисляться водяным паром до оксида при высокой температуре: Fe + 4Н2O-tà Fe3O4 + 4Н2
2. С оксидами щелочных и щелочноземельных металлов: Н2O + СаО = Са(OH)2
3. С кислотными оксидами растворимых кислот: P2O5 + 3H2O = 2H3PO4.
4. Гидролиз солей, бинарных соединений металлов и неметаллов:
2CuSO4 + 2Н2O ⇄ (CuOH)2SO4 + H2SO4
Al2S3 + 6H2O à 2Al(OH)3 + 3H2S
Са3Р2 + 6Н2О à 3Са(ОН)2 + 2РН3↑
PCl5 + 4H2O à H3PO4 + 5HCl
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварки металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- для получения аммиака и искусственного жидкого топлива, для гидрогенизации жиров.
ГАЛОГЕНЫ.
Это элементы VII-A группы. Являются типичными неметаллами. На внешнем электронном слое содержится 7 электронов (ns2np5). В природе встречаются в виде соединений или ионов (в морской воде).
Проявляют степени окисления от -1 до +7 (фтор – только -1). Молекулы состоят из двух атомов, связанных одной ковалентной неполярной связью. Плохо растворимы в воде, все имеют запах, летучи. Хорошо растворяются в неполярных растворителях.
ФТОР F2 – газ светло-желтого цвета.
Получение:
электролиз расплава гидрофторида калия KHF2: 2KHF2 -эл/токà 2K + H2 + 2F2
Химические свойства:
F2 – самый сильный окислитель из всех веществ.
| 1. Реагирует с водородом, образуя фтороводород: | H 2 + F2 ® 2HF (со взрывом) |
| 2. Реагирует с другими галогенами: | Cl2 + F2 ® 2ClF |
| 3. Окисляет воду, при этом выделяется кислород: | 2F2 + 2H2O ® 4HF + O2 |
| 4. С металлами (часто со взрывом), включая золото. | 2К + F2 ® 2KF 2Au + 3F2 ® 2AuF3 |
| 5. С другими неметаллами | S + 3F2 ® SF6 |
| 6. Вытесняет другие галогены из растворов их солей и водородных соединений | 2НС1 + F2 ® 2HF + С12 |
Фтористый водород
Едкий газ, хорошо растворим в воде с образованием плавиковой кислоты.
Получение: из фторида кальция: CaF2 + H2SO4(конц.) ® CaSO4 + 2HF
ХИМИЧЕСКИЕ СВОЙСТВА:
| 1) Раствор HF в воде – слабая кислота (плавиковая) | HF⇄H+ + F-Соли плавиковой кислоты – фториды. |
| 2) Реагирует с основаниями и основными оксидами: | HF + NaOH = NaF + H2O 2HF + MgO = MgF2 + H2O |
| 3) Плавиковая кислота растворяет стекло: | SiO2 + 4HF ® SiF4+ 2H2O |
Фторид кислорода О+2F2
В этом соединении кислород проявляет положительную степень окисления. Это бесцветный газ, плохо растворимый в воде.
Фтор не образует соединения типа ННаlОn
ХЛОР Cl2
Газ желто-зеленого цвета с едким запахом. Ядовит. Используется для обеззараживания.
ПОЛУЧЕНИЕ:
1) Электролиз раствора NaCl (промышленный способ):
2NaCl + 2H2O ® H2 + Cl2 + 2NaOH
2) Окисление ионов Cl- сильными окислителями:
MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl ® 2MnCl2 + 5Cl2 + 2KCl + 8H2O
K2Cr2O7 + 14HCl ® 2CrCl3 + 2KCl + 3Cl2 + 7H2O
ХИМИЧЕСКИЕ СВОЙСТВА:
| 1) Реакции с металлами: | 2Na + Cl2 ® 2NaCl 2Fe + 3Cl2 ® 2FeCl3 |
| 2) Реакции с неметаллами. С кислородом не реагирует. | H2 + Cl2 –hn® 2HCl 2P + 5Cl2 ® 2PCl5 |
| 3) Реакция с водой: | Cl2 + H2Oà HCl + HClO (диспропорционирование) 3Сl2 + 3H2O –t°® 5HCl + HClO3 |
| 4) Реакции со щелочами: | Cl2 + 2KOH –5°C® KCl + KClO + H2O 3Cl2 + 6KOH –40°C® 5KCl + KClOЗ + 3H2O Cl2 + Ca(OH)2 ® CaOCl2(хлорная известь) + H2O |
| 5) Вытесняет бром и йод из галогеноводородных кислот и их солей. | Cl2 + 2KI ® 2KCl + I2 Cl2 + 2HBr ® 2HCl + Br2 |
| 6) Окисляет бром и йод: | Cl2 + I2 +H2O → HCl + HIO3 |
ХЛОРИСТЫЙ ВОДОРОД
Бесцветный газ с резким запахом, ядовитый, тяжелее воздуха, хорошо растворим в воде.
ПОЛУЧЕНИЕ:
1) Синтетический способ (промышленный): H2 + Cl2 ® 2HCl
2) Гидросульфатный способ (лабораторный): NaCl(тв.) + H2SO4(конц.) ® NaHSO4 + HCl↑
ХИМИЧЕСКИЕ СВОЙСТВА:
| 1) Раствор HCl в воде – соляная кислота (сильная, одноосновная) | HCl à H+ + Cl- |
| 2) Реагирует с металлами, стоящими в ряду напряжений до водорода: | 2Al + 6HCl ® 2AlCl3 + 3H2 |
| 3) с оксидами металлов: | MgO + 2HCl ® MgCl2 + H2O |
| 4) с основаниями и аммиаком: | HCl + KOH ® KCl + H2O 3HCl + Al(OH)3 ® AlCl3 + 3H2O HCl + NH3 ® NH4Cl |
| 5) с солями: | CaCO3 + 2HCl ® CaCl2 + H2O + CO2 HCl + AgNO3 ® AgCl¯ + HNO3 |
Образование белого осадка хлорида серебра, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl- в растворе:
HCl + AgNO3 ® AgCl¯ + HNO3
ХЛОРИДЫМЕТАЛЛОВ – соли соляной кислоты.
ПОЛУЧЕНИЕ:
| 1) взаимодействием металлов с хлором: | 2Fe + 3Cl2 ® 2FeCl3 |
| 2) реакция соляной кислоты с металлами, | Mg + 2HCl ® MgCl2 + H2 |
| 3) реакция соляной кислоты с оксидами | CaO + 2HCl ® CaCl2 + H2O |
| 4) с гидроксидами | Ba(OH)2 + 2HCl ® BaCl2 + 2H2O |
| 5) реакции обмена с некоторыми солями: | Pb(NO3)2 + 2HCl ® PbCl2¯ + 2HNO3 |
| 6) Замещение металлом другого металла в соли: | Mg + CuС12 à MgС12 + Cu |
СВОЙСТВА:
| 1) Растворимые хлориды вступают в обменные реакции, если образуется осадок, газ или вода: | NaCl + AgNO3 à AgCl ¯+ NaNO3 |
| 2) Хлориды тяжелых металлов реагируют с более активными металлами – реакция замещения | Mg + CuС12 à MgС12 + Cu |
| 3) В процессе электролиза на аноде выделяется газообразный хлор | 2NaCl + 2H2O –эл.токà 2NaOH + Cl2 + H2 в растворе 2NaCl –эл.токà 2Na+ Cl2 только в расплаве CuCl2 –эл.токà Cu + Cl2 и в растворе, и в расплаве |
Оксиды и кислородсодержащие кислоты хлора
| +1 | +3 | +5 | +7 |
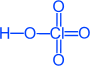
| Хлорноватистая кислота HCl+1O. Существует только в виде разбавленных водных растворов. | Хлористая кислота HCl+3O2. Существует только в водных растворах. | Хлорноватая кислота HCl+5O3. Устойчива только в водных растворах. | Хлорная кислота HCl+7O4. Бесцветная жидкость |
| H–O–Cl | H–O–Cl=O | 
| 
|
| Соли – гипохлориты | Соли – хлориТы | Соли – хлораты | Соли – перхлораты |
| Получение: Cl2 + H2O «HCl + HClO | Получение: 2ClO2 + H2O2 ® 2HClO2 + O2 | Получение: Ba (ClO3)2 + H2SO4 ® 2HClO3 + BaSO4¯ | Получение: KClO4 + H2SO4 ® KHSO4 + HClO4 |
| HClO- слабая кислота и сильный окислитель: 1) Разлагается на свету: HClO–свет®HCl+ O2 2) Реагирует со щелочами: HClO + KOH ® KClO + H2O HClO + Са(OH)2 ® СаOС12 + H2O хлорная известь 3) Окислитель: 2HI + HClO ® I2+ HCl + H2O 4) Диспропорционирование: 3HClO ® 2HCl + НС1O3 | HClO2 - слабая кислота и сильный окислитель. 1) Со щелочами HClO2 + KOH ® KClO2 + H2O 2) Неустойчива, при хранении разлагается 4HClO2 ® HCl + HClO3 + 2ClO2 + H2O | HClO3- Сильная кислота и сильный окислитель. 1) 6P + 5HClO3 ® 3P2O5 + 5HCl 2) HClO3 + KOH ® KClO3 + H2O Хлорат калия – бертоллетова соль – при нагревании разлагается: 4KClO3 –без кат®KCl + 3KClO4 2KClO3 -MnO2® 2KCl + 3O2 | HClO4 - очень сильная кислота и очень сильный окислитель. 1) Со щелочами HClO4 + KOH ® KClO4 + H2O 2) При нагревании хлорная кислота и ее соли разлагаются: 4HClO4 –t°® 4ClO2 + 3O2 + 2H2O KClO4 –t°® KCl + 2O2 |
БРОМ Br2
Это бурая жидкость с тяжелыми ядовитыми парами; имеет неприятный запах.
ПОЛУЧЕНИЕ.
Окисление ионов Br- сильными окислителями:
MnO2 + 4HBr ® MnBr2 + Br2 + 2H2O
Cl2 + 2KBr ® 2KCl + Br2
ХИМИЧЕСКИЕ СВОЙСТВА.
| 1) Реагирует с металлами: | 2Al + 3Br2 ® 2AlBr3 |
| 2) Реагирует с неметаллами. С кислородом не реагирует. | H2 + Br2 «2HBr 2P + 5Br2 ® 2PBr5 |
| 3) Реагирует с водой и щелочами: | Br2 + H2O «HBr + HBrO Br2 + 2KOH ® KBr + KBrO + H2O |
| 4) Реагирует с сильными восстановителями: | Br2 + 2HI ® I2 + 2HBr Br2 + H2S ® S + 2HBr |
БРОМИСТЫЙ ВОДОРОД HBr
Бесцветный газ, хорошо растворим в воде. Раствор в воде – сильная бромоводородная кислота.
ПОЛУЧЕНИЕ
1) Вытеснение из бромидов кислотой-неокислителем:
2NaBr + H3PO4 –t°® Na2HPO4 + 2HBr
2) Гидролиз бромидов неметаллов:
PBr3 + 3H2O ® H3PO3 + 3HBr
ХИМИЧЕСКИЕ СВОЙСТВА.
Бромоводородная кислота еще более сильная, чем соляная. Она вступает в те же реакции, что и HCl:
| 1) Диссоциация: | HBr «H+ + Br - |
| 2) С металлами, стоящими в ряду напряжения до водорода: | Mg + 2HBr ® MgBr2 + H2 |
| 3) с оксидами металлов: | CaO + 2HBr ® CaBr2 + H2O |
| 4) с основаниями и аммиаком: | NaOH + HBr ® NaBr + H2O Fe(OH)3 + 3HBr ® FeBr3 + 3H2O NH3 + HBr ® NH4Br |
| 5) с солями: | MgCO3 + 2HBr ® MgBr2 + H2O + CO2 AgNO3 + HBr ® AgBr¯ + HNO3 |
| 6) HBr – сильный восстановитель: | 2HBr + H2SO4(конц.) ® Br2 + SO2 + 2H2O 2HBr + Cl2 ® 2HCl + Br2 |
| Образование желтовато-белого осадка бромида серебра используется в качестве качественной реакции для обнаружения анионов Вr- в растворе: HBr + AgNO3 ® AgBr¯ + HNO3 |
ЙОД I2
Кристаллическое вещество темно-фиолетового цвета с металлическим блеском. При нагревании возгоняется (переходит из твердого состояния сразу в газ, минуя жидкое).
ПОЛУЧЕНИЕ.
Окисление ионов I- сильными окислителями:
Cl2 + 2KI ® 2KCl + I2
2KI + MnO2 + 2H2SO4 ® I2 + K2SO4 + MnSO4 + 2H2O
ХИМИЧЕСКИЕ СВОЙСТВА.
| 1) c металлами: | 2Al + 3I2 ® 2AlI3 |
| 2) c водородом: | H2 + I2 «2HI |
| 3) с сильными восстановителями: | I2 + SO2 + 2H2O ® H2SO4 + 2HI I2 + H2S ® S + 2HI |
| 4) со щелочами: | 3I2 + 6NaOH ® 5NaI + NaIO3 + 3H2O |
| 5) с хлором: | I2 + 5Cl2 + 6H2O à 10HCl + 2HIO3 |
ИОДИСТЫЙ ВОДОРОД HI
Бесцветный газ с резким запахом, хорошо растворим в воде. Раствор в воде – сильная одноосновная иодоводородная кислота.
Получение:
Восстановление йода сероводородом: I2 + H2S ® S + 2HI
Химические свойства:
| 1) Раствор HI в воде - сильная йодоводородная кислота: | Соли йодоводородной кислоты – йодиды 2HI + Ba(OH)2 ® BaI2 + 2H2O 2HI + BaO ® BaI2 + H2O 2HI + BaСO3 ® BaI2 + СО2 + 2H2O |
| 2) HI – очень сильный восстановитель: | 2HI + Cl2 ® 2HCl + I2 8HI + H2SO4(конц.) ® 4I2 + H2S + 4H2O 5HI + 6KMnO4 + 9H2SO4 ® 5HIO3 + 6MnSO4 + 3K2SO4 + 9H2O |
| Идентификация анионов I- в растворе: NaI + AgNO3 ® AgI¯ + NaNO3 HI + AgNO3 ® AgI¯ + HNO3 Образуется темно-желтый осадок йодида серебра, нерастворимый в кислотах. |