KI + AgNO3 = AgI + KNO3
Важно: золь образуется из очень разбавленных растворов.
1) при избытке нитрата серебра образуется положительный золь.
Таблица 2.
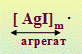
| Из m частиц AgI возникают микрокристаллики, образующие агрегат (выделяется квадратными скобками) [AgI]m. |
nAgNO3 → nAg+ + nNO3-

| Он адсорбирует на своей поверхности n ионов вещества, взятого в избытке и входящего в состав ядра (избирательная адсорбция – правило Панета – Фаянса - на поверхности твердой частицы избирательно адсорбируются только те ионы, которые способны достроить ее кристаллическую решетку или изоморфны с ней), т.е. Ag+. Они удерживаются на поверхности агрегата за счет образования ионных связей. Электронейтральный агрегат частиц и ионы серебра образуют ядро. В результате адсорбции ионов серебра на поверхности кристалла иодида серебра образуется положительный электрический заряд +n, возникает потенциал, который приостанавливает дальнейшую адсорбцию ионов серебра. Ионы Ag+ называются потенциалопределяющими. |
 положительный золь
положительный золь
| Этот положительный заряд притягивает из раствора силами электростатического притяжения ионы NO3-, их адсорбируется только некоторая часть (n-x); это адсорбционный слой - противоионный. Ядро и адсорбционный слой составляют гранулу (выделяется фигурными скобками) {[AgI]m · n Ag+ · (n-x) NO3-}+х. Заряд гранулы определяет заряд золя (положительный или отрицательный золь). |
 положительный золь
положительный золь
| Оставшиеся противоионы NO3- неравномерно распределяются по дисперсионной среде, образуя диффузный слой. Концентрация ионов в диффузном слое уменьшается от ядра коллоида к периферии. Гранула вместе с ионами диффузионного слоя называется мицеллой (лат. micella – крошка, крупинка). |
Между заряженной гранулой и диффузионным слоем возникает двойной электрический слой (ДЭС) – разность потенциалов – электрокинетический потенциал или дзета-потенциал (ξ).
2) при избытке иодида калия образуется отрицательный золь:
{[AgI]m · n I- · (n-x) K+ }х- · x K+
или {m[AgI] · n I- · (n-x) K+ }х- · x K+

| Рис. 2. Схема ДЭС частицы гидрозоля AgI: 1 – адсорбционный слой потенциалобразующих ионов; 2 – плотный слой противоионов; 3 – диффузный слой противоионов. |
Образование гидрофобного золя сульфата бария:
BaCl2 + K2SO4 = BaSO4 + 2KCl
a) избыток сульфата калия:
n K2SO4 → 2nK+ + nSO42-
{[BaSO4]m · nSO42- · 2(n-x) K+ }2х- · 2xK+
б) избыток хлорида бария:
n BaCl2 → nBa2+ + 2nCl-
{[BaSO4]m · nBa2+ · 2(n-x) Cl- }2х+ · 2xCl-
Гранула может не иметь заряда. Такое состояние коллоидной системы называется изоэлектрическим. Дзета-потенциал равен нулю.
6. Свойства коллоидных систем:
1) Молекулярно-кинетические.
а) Свойства, связанные с тепловым движением частиц - броуновское движение, диффузия, осмотическое давление, температуры замерзания, кипения и др. – у коллоидных растворов выражены слабее, чем у истинных растворов. Это связано с большими размерами коллоидных частиц и меньшей концентрацией, при одинаковой массе веществ.
б) Седиментация – оседание коллоидных частиц под действием силы тяжести. Этому противодействует диффузия. Со временем устанавливается седиментационное равновесие, при котором концентрация дисперсной фазы равномерно понижается от нижних слоев к верхним и остается постоянным во времени.
2) Оптические свойства. Коллоидные частицы имеют диаметр меньше ½ длины световой волны, поэтому возможно дифракционное рассеивание света. Путь светового луча, проходящего через прозрачный коллоидный раствор, на темном поле, становится видимым – наблюдается конус Тиндаля. Это явление похоже на рассеяние света запыленным воздухом. При пропускании света через истинные растворы конус Тиндаля не наблюдается – они прозрачные. При пропускании света через взвесь частицы отражают свет, наблюдается освещенность всего раствора, и они выглядят мутными.
Кроме того, окраска бесцветного золя зависит от освещения: в отраженном свете сине-голубой цвет, в проходящем свете – желто-красный. Наблюдается опалесценция (переливчатое свечение), возникающая из-за рассеивания света на флуктуациях (неоднородностях) плотности, вследствие дифракции.
Например: голубой цвет неба (капельки воды, флуктуации плотности газов атмосферы), табачного дыма, керосина, обезжиренного молока. Красный цвет небесных светил при расположении вблизи горизонта.Использование оптических свойств коллоидных систем: нефелометрия, турбодиметрия, ультрамикроскопия.
3) Электрокинетические свойства – электрофорез и электросмос, потенциал течения и потенциал седиментации.
4) Устойчивость коллоидных систем (метод. рук-во, стр. 167-168): седиментационная, агрегативная устойчивость лиозолей. Коагуляция. Порог коагуляции.
| Cп(Х) = | Сэл ∙ Vэл ∙ 1000 Vр-ра + Vэл | Cп(Х) – порог коагуляции, ммоль/л (миллимоль электролита на 1л золя). Сэл – исходная концентрация, моль/л; | |
| Vэл – наименьший объем раствора электролита, вызывающий коагуляцию, л; Vр-ра – объем коллоидного раствора, л. | |||
Коагулирующая способность К.С. = 1/ Cп(Х)
Правило Щульце-Гарди. К.С. = f (z6).
Перезарядка коллоидных частиц. Явление привыкания. Антагонизм, синергизм, аддитивность. Взаимная коагуляция. Пептизация.
7. Защита коллоидных систем.
8. Коллоидные ПАВ. Биологически важные коллоидные ПАВ (мыла, детергенты, желчные кислоты). Основные свойства водных растворов ПАВ. Мицеллообразование в растворах ПАВ. Критическая концентрация мицеллообразования – ККМ. Солюбилизация. Определение критической концентрации мицеллообразования.