Экспериментально определенное осмотическое давление для растворов многих ВМС данной концентрации значительно превышает вычисленное по уравнению Вант-Гоффа: p = СRT, причина в высокой подвижности фрагментов ВМС, одна макромолекула по влиянию на осмотическое давление ведет себя как несколько молекул меньшего размера. Для расчета осмотического давления растворов ВМС применяют уравнение Галлера:
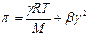 , где , где
| γ – массовая концентрация раствора ВМС, г/л; М – молярная масса ВМС, г/моль; b – коэффициент, учитывающий гибкость и форму макромолекул в растворе. |
Осмометрический метод применяется при определении молярной массы полимеров.
14. Онкотическое давление плазмы крови. Онкотическое давление крови – часть осмотического давления, создаваемая растворенными в ней белками (альбумины, глобулины). Доля онкотического давления составляет 0,5% от суммарного осмотического давления. В артериальной части капилляров гидростатическое давление больше онкотического, в венозной меньше (рис. 7).

Рис. 4. Осмотическое равновесие
В артериальной части тканевых капилляров гидростатическое давление крови способствует, а онкотическое давление крови препятствует выходу воды из крови. В венозной части капилляров происходит осмос воды из ткани в кровь. Онкотическое давление способствует, а гидростатическое давление препятствует вхождению воды в кровь.
15. Изоэлектрическая точка и методы ее определения ИЭТ или pI.
Полиэлектролиты. Полиамфолиты. Изоэлектрическое состояние.
| R ¾ NH3+ ï СООН | -Н ® +Н | R ¾ NH3+ ï СОО- | -Н ® +Н | R ¾ NH2 ï СОО- |
| рН < ИЭТ | рН = ИЭТ | рН > ИЭТ | ||
| макрокатион | макромолекула | макроанион |
Рис.5. Полиамфолиты в разных средах.
Методы определения ИЭТ:
Прямые методы – электрокинетические методы, например электрофорез. При этом определяют рН раствора белка, при котором электрофоретическая подвижность частиц минимальна. Изоэлектрическая точка большинства белков меньше 7: для желатина ИЭТ равна 4,7, для казеина — 4,6, для глобулина — 5,4, для пепсина – 1, что говорит о преобладании кислых аминокислот.

| 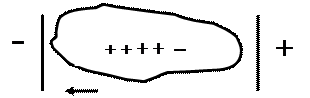
|
| рН > ИЭТ макроанион | рН < ИЭТ макрокатион |

| ||
| рН = ИЭТ макромолекула |
Рис. 6. Движение частиц белка в электрическом поле
16. Мембранное равновесие Доннана.
Равновесие Доннана – избирательная проницаемость клеточных мембран, вызывающая особое перераспределение электролитов по разные ее стороны.
| I – внутриклеточная жидкость (англ.internel) | II – внеклеточная жидкость (англ. externel) | Рис.7 Таблица 1 . | |
| Раствор полиэлектролита а Kt→, а An→ | мембрана | Раствор низкомолекулярного вещества а Kt, а An | При соблюдении условия: а Kt→ ∙ а An→ = а Kt ∙ а An |
равновесие Доннана описывается уравнением:
| Х = | ___Сех 2__ Сin + 2Сех | , где | Х – количество ионов, перешедших в раствор с ВМС при контакте с раствором НМС; Сех – концентрация ионов в растворе с НМС; Сin – концентрация ионов в растворе с ВМС. |
17. Высаливание биополимеров из раствора. Лиотропные ряды:
Li > Na K > Rb > Cs > Mg2+ > Ca2+ > Sr2+ > Ba2+
SO42- > CH3COO- > C1- > NO3- > Br- > CNS-.