Тема: Свойства алканов
Дата: 06.09.2020 (1 час)
Цель:
дать характеристику предельных углеводородов.
Задачи: формировать представление о нахождении в природе, физических свойствах, химических свойствах, применении и получении алканов.
Студенты должны знать: гомологический ряд алканов; виды изомерии алканов.
Студенты должны уметь: составлять уравнения реакции, характеризующие химические свойства и способы получения алканов.
План.
1. Понятие об алканах.
2. Гомологический ряд алканов.
3. Виды изомерии алканов.
4. Физические свойства.
5. Получение.
6. Химические свойства.
Опорный конспект
1. Алканы - предельные ациклические углеводороды в молекулах которых все атомы углерода связаны одинарными связями и имеют общую формулу: CnH2n+2
Углерод в любом органическом соединении четырех валентный! А это значит, что он может присоединить к себе четыре других химических элементов.
2. Гомологический ряд алканов.
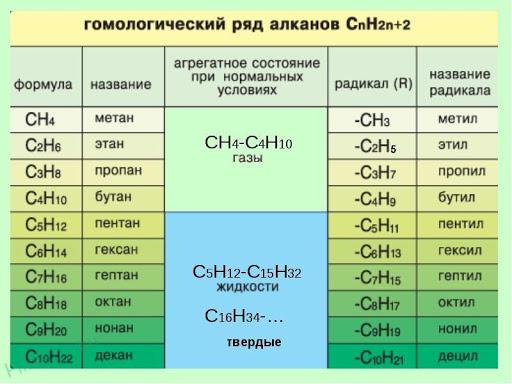
Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного, указывающего число атомов углерода в молекуле, и суффикса –ан: пентан С5Н12, гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т.д.
3. Виды изомерии алканов:
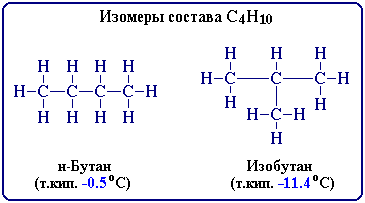
В ряду алканов структурная изомерия углеродного скелета начиная с бутана С4Н10
Структурная изомерия алканов
Причиной проявления структурной изомерии в ряду алканов является способность атомов углерода образовывать цепи различного строения. Этот вид структурной изомерии называется изомерией углеродного скелета.
Например, алкан состава C4H10 может существовать в виде двух структурных изомеров:
4. Физические свойства
Гомологи отличаются молекулярной массой и, следовательно, физическими характеристиками. С увеличением числа углеродных атомов в молекуле алкана (с ростом молекулярной массы) в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов (переход количества в качество): повышаются температуры кипения и плавления, увеличивается плотность. Алканы от СН4 до С4Н10 – газы, от С5Н12 до С17Н36 – жидкости, далее – твердые вещества.
С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
5. Получение
Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь).
Используются также синтетические методы.
Крекинг нефти (промышленный способ)
CnH2n+2 ® CmH2m+2 + Cn-mH2(n-m)
алкан алкен
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др.
2. Гидpиpование непpедельных углеводоpодов:
H2 2H2
CnH2n ® CnH2n+2 CnH2n-2
алкены алканы алкины
3. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода:
2CH3Cl + 2Na ® CH3-CH3 + 2NaCl (синтез Вюpца) Это то что мы с вами разбирали в лекции!
хлорметан этан
4. Из солей карбоновых кислот:
сплавление со щелочью (реакция Дюма)
t°
CH3COONa + NaOH ® CH4 + Na2CO3
ацетат натрия
5. Разложение карбидов металлов водой:
Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4
6. Химические свойства
Для алканов характерны следующие типы химических реакций: замещение атомов водорода; дегидрирование; крекинг; окисление.
1) Замещение атомов водорода:
А) Реакция галогенирования:
CH4 +Cl2 ® CH3Cl + HCl
Б) Реакция нитрования (Коновалова):
CH4 + HNO3®CH3-NO2 + H2O + Q
В) Реакция сульфирования:
CH4 + H2SO4 ® CH3-SO3 H + H2O
2) Реакция изомеризации:
бутан ®изобутан
3) Реакция с водяным паром:
CH4 + H2O ®CO + 3H2
4) Реакция дегидрирования:
2СН4 ® НС=СН + 3Н2
5) Реакция окисления:
CH4 + 2O2 ® Н-C=O + 2H2O
6) Горение метана:
CH4 + 2O2 ®CO2 + 2H2O
Практическое задание.
1. Написать структурные формулы следующих соединений: метан, октан, пропан, октан, 2-метилпентан, соблюдая валентность углерода
2. Ответить письменно на вопрос: где применяются алканы или для чего?
Критерии оценивания.
Оценка «отлично» - выполнены все задания правильно.
Оценка «хорошо» - допущена 1 ошибка.
Оценка «удовлетворительно» - допущены 2 ошибки.
Оценка «неудовлетворительно» - допущено более 2 ошибок.
Уважаемые студенты, практическое задание необходимо выполнить в рабочей тетради (сфотографировать) или в формате Документа Word. Отправлять для проверки в личные сообщения на страницу ВКонтакте: https://vk.com/id343837166 Преподаватель: Острик Марина Григорьевна