Тема: Амины
Дата: 06.09.2020 (1 час)
Цель: изучить строение и свойства класса аминов.
Задачи:
рассмотреть строение, классификацию и свойства класса аминов; закрепить знания о причинах многообразия аминов; познакомить с областями применения аминов.
Студенты должны знать: строение предельных алифатических аминов; химические свойства аминов.
Студенты должны уметь: о бъяснять зависимость свойств органических соединений от их строения на примере аминов; отличать основные свойства аминов от кислотных.
План.
1. Понятие об аминах.
2. Номенклатура.
3. Классификация.
4. Изомерия.
5. Физические свойства.
6. Химические свойства.
7. Получение.
8. Применение.
Опорный конспект
В органической химии есть вещества, содержащие не только атомы кислорода, как спирты, альдегиды и карбоновые кислоты, но и соединения, в состав которых входят атомы азота. Их так и называют азотсодержащие органические соединения.
К азотсодержащим органическим соединениям относятся: нитросоединения, содержащие нитрогруппу, связанную с углеводородным радикалом. К азотсодержащим органическим соединениям относятся также амины, аминокислоты и белки.
Большой вклад в изучение и получение азотосодержащих органических соединений внесли русские учёные А. Я. Данилевский и Н. Н. Зинин.

Амины можно представить как производные аммиака, в молекулах которого один или несколько атомов водорода заменены на углеводородные радикалы.
В зависимости от числа углеводородных групп, замещающих атомы водорода в молекуле аммиака, различают первичные, вторичные и третичные амины.
В зависимости от природы углеводородных заместителей амины делятся на: алифатические, например метиламин, алициклические, как циклогексиламин и ароматические, как фениламин, или анилин.

В состав первичных аминов входит группа – NH2, которую называют аминогруппой. Поэтому общая формула первичных аминов R – NH2, или CnH2n+1NH2, где CnH2n+1 – алкильная группа.
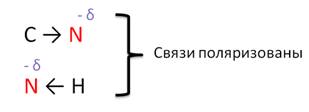
В молекулах аминов связи C – N и N – H поляризованы, потому что атом азота является более электроотрицательным, чем атомы углерода и водорода, но полярность связи в аминах выражена меньше, чем в спиртах, поэтому и реакции замещения менее характерны.
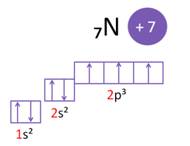
Свойства аминов также обусловлены особенностями строения атома азота. Так, в атоме азота на внешнем энергетическом уровне три неспаренных электрона, которые могут образовывать связи с другими атомами. А одна пара электронов у атома азота остаётся неподелённой.
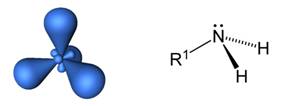
Атом азота в аминах имеет тетраэдрическую ориентацию орбиталей, а сама молекула – тригонально-пирамидальную структуру.
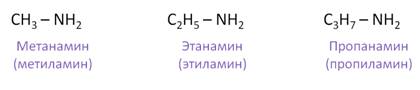
Названия первичных аминов по заместительной номенклатуре состоит из названия исходных углеводородов с добавлением слова «амин». Назовём первичные амины. Первый амин называется метанамин, или метиламин, второй – этанамин, или этиламин, третий амин называется пропанамин, или пропиламин.
Вторичные амины по номенклатуре ИЮПАК называют следующим образом: указывают наличие атома азота символом N и после дефиса перечисляют младшую, потом старшую углеводородные группы, добавляя в конце слово «амин». Назовём вторичные амины.

Для аминов характерна структурная изомерия, которая обусловлена изомерией углеродного скелета (изомерия цепи) и изомерия положения аминогруппы.
Составим всевозможные изомеры к амину состава C5H11NH2. Изомерия углеродной цепи будет представлена изомерами: пентанамином-1, 2-метилбутанамином-1 и 2, 2-диметилпропанамином-1.
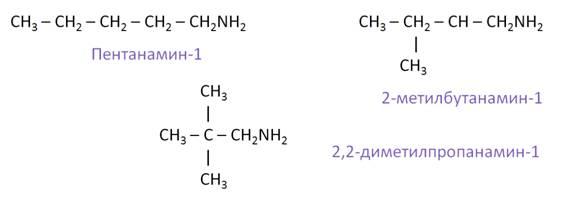
Изомерия положения аминогруппы представлена такими изомерами, как: пентанамин-1, пентанамин-2, пентанамин-3.
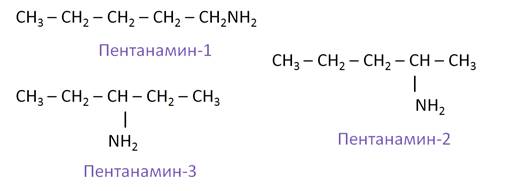
Первичные, вторичные и третичные амины, у которых одинаковое число атомов углерода, изомерны между собой. Так, изомерами между собой являются этиламин и диметиламин.
CH3 – CH2 – NH2
(CH3)2NH
Метиламин, диметиламин и триметиламин – газообразные вещества, с запахом аммиака, хорошо растворяются в воде, так как их молекулы образуют водородные связи с молекулами воды. Средние члены алифатического ряда – жидкости со слабым запахом тухлой рыбы, с постепенно повышающейся температурой кипения. Высшие амины – твёрдые нерастворимые вещества, не имеющие запаха.
Связь N – H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О – Н).
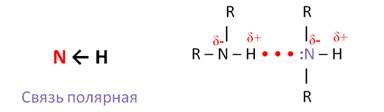
Это объясняет относительно высокую температуру кипения аминов по сравнению с алканами со схожей молекулярной массой. Амины кипят при более низкой температуре, чем спирты со схожей молекулярной массой, так как межмолекулярные водородные связи в них менее прочные из-за меньшей электроотрицательности азота.
Амины широко распространены в природе. Например, многие биологически активные вещества относятся к аминам.
Триметиламин впервые был выделен в середине 19 века из продуктов перегонки селёдочного рассола, поэтому он и получил название «рыбный газ» и имел специфический запах рыбы. Триметиламин получилось выделить и из слёз человека, желудочного сока, поджелудочной железы.
Химические свойства аминов обусловлены наличием аминогруппы, а в частности наличием неподелённой пары электронов у атома азота. Эта непроделённая пара электронов может образовывать химическую связь по донорно-акцепторному механизму. Поэтому амины – это органические основания.

Например, при растворении метиламина в воде образуется щелочной раствор и ион метиламмония.
CH3NH2 + HOH ↔ CH3NH3+ + OH-
Амины реагируют с неорганическими кислотами с образованием аммониевых солей. Так, в реакции метиламина с соляной кислотой образуется соль – хлорид метиламмония, в реакции этиламина с серной кислотой образуется соль – гидросульфат этиламмония.
CH3 – NH2 + HCl → CH3 – NH3Cl
C2H5 – NH2 + H2SO4 → C2H5NH3HSO4
Если на полученную соль подействовать более сильным основанием, то образуется исходный амин. Так, при действии на соль – гидросульфат этиламмония гидроксидом натрия образуется этиламин.
C2H5NH3HSO4 + NaOH → C2H5NH2 + NaHSO4 + H2O
Для аминов, как и других органических соединений, характерны реакции горения. Так, при горении метиламина образуется оксид углерода (IV), вода и азот.
4CH3NH2 + 9O2 → 4CO2↑ + 10H2O + 2N2↑
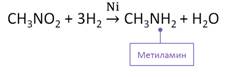
В лаборатории первичные амины получают восстановлением нитросоединений. Так, при восстановлении нитрометана водородом в присутствии никелевого катализатора образуется метиламин и вода.
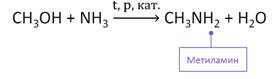
В промышленности амины получают в реакции спирта и аммиака под давлением. Так, в реакции метанола с аммиаком в присутствии катализатора – оксида алюминия, образуется метиламин.
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза, для получения взрывчатых веществ. Гексаметилендиамин при поликонденсации с адипиновой кислотой даёт полиамидные волокна. Многие амины и их производные применяют в косметической, пищевой, нефтехимической промышленности.
Таким образом, аминами называются производные аммиака, в которых атомы водорода замещены на углеводородные радикалы. Функциональной группой аминов является NH2 – группа – аминогруппа. Для аминов характерна структурная изомерия: изомерия углеродной цепи и положения аминогруппы. Амины проявляют основные свойства в реакциях с неорганическими и органическими кислотами. Получают амины из нитросоединений и спиртов. Амины находят широкое применение в производстве красителей, лекарственных и взрывчатых веществ.
Практическое задание.
Ответить на предложенные вопросы:
1. Как классифицируют азотсодержащие органические соединения?
2. Что такое амины? Назвать функциональную группу и общую формулу.
3. Как классифицируют амины? Привести примеры.
4. К каким соединениям относятся амины по химическим свойствам? Как изменяется цвет индикаторов под действием водных растворов аминов?
5. Где применяются амины?
Критерии оценивания.
Оценка «отлично» - даны ответы на 5 вопросов правильно.
Оценка «хорошо» - даны ответы на 4 вопроса правильно.
Оценка «удовлетворительно» - даны ответы на 3 вопроса правильно.
Оценка «неудовлетворительно» - даны ответы на 2 или 1 вопрос.
Уважаемые студенты! Практическое задание необходимо выполнить в рабочей тетради (сфотографировать) или в формате Документа Word. Отправлять для проверки в личные сообщения на страницу ВКонтакте: https://vk.com/id343837166
Преподаватель: Острик Марина Григорьевна
Тема: Анилин
Дата: 06.09.2020 (1 час)
Цель: продолжить изучение аминов на примере анилина.
Задачи:
рассмотреть строение и свойства анилин; изучить способы получения и применения анилина, меры предосторожности при работе с анилином.
Студенты должны знать: х имические свойства анилина.
Студенты должны уметь: н азывать гомологи анилина по номенклатуре; иметь представление о качественных реакциях на анилин.
План.
1. Понятие об анилине.
2. Физические свойства.
3. Химические свойства.
4. Получение анилина в лаборатории и промышленности.
5. Применение. Вредное воздействие на человека.
Опорный конспект
Анилин – это ароматический амин. Его называют так, потому что аминогруппа у него связана непосредственно с атомом углерода бензольного кольца.
Анилин, или фениламин, имеет формулу С6H5NH2.
Он представляет собой бесцветную маслянистую жидкость с характерным запахом, мало растворим в воде, но хорошо растворяется в этаноле и бензоле. (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Рассмотрим химические свойства анилина. Он реагирует с кислотами. Так, в реакции анилина с соляной кислотой образуется хлорид фениламмония.
С6H5NH2 + HCl → [С6H5NH3]+ Cl-
Эта реакция подтверждает тот факт, что аммиак и амины – основания, причём амины более сильные основания.
Однако анилин – более слабое основание, чем алифатические амины. Это объясняется наличием в его молекуле бензольного кольца, которое оказывает влияние на неподелённую пару электронов атома азота. Электронная пара электронов атома азота также взаимодействует с электронным облаком бензольного кольца, что приводит к ослаблению основных свойств.
Таким образом, основные свойства у аммиака выражены сильнее, чем у анилина; у первичных аминов основные свойства выражены сильнее, чем у аммиака, а наиболее выраженными основными свойствами обладают вторичные амины.
Для анилина характерна реакция горения, при этом образуется оксид углерода (IV), азот и вода.
4CH3NH2 + 9O2 → 4CO2↑ + 2N2↑ + 10H2O
Для анилина характерны реакции галогенирования. Так, в реакции анилина с бромной водой образуется белый осадок 2,4,6-триброманилина.
C6H5NH2 + 3Br2 → C6H2NH2Br3↓ + 3HBr
Эту реакцию используют для обнаружения анилина.
Эта реакция подтверждает влияние аминогруппы на бензольное кольцо. Аминогруппа активирует бензольное кольцо, поэтому реакция бромирования анилина идёт легче, чем в бензоле.
В реакции анилина с хлорангидридом уксусной кислоты получают ацетанилид, который использовали как первое синтетическое жаропонижающее средство.
В реакции анилина с серной кислотой образуется вещество, которое называют ещё сульфаниловой кислотой, это вещество используют как промежуточное вещество в синтезе лекарственных средств и красителей.
С древних времён люди использовали природный краситель синего цвета – индиго. Из-за того, что этот краситель стоил очень дорого, учёные давно пытались его синтезировать.
Адольф Байер − немецкий химик, профессор Страсбургского и Мюнхенского университетов. Ему принадлежат замечательные синтезы органических соединений, в том числе синтез индиго − важнейшего природного красителя. Исследовал реакции конденсации. Изучал многие классы органических соединений. Лауреат Нобелевской премии
В 1840 году Фрицше обнаружил, что при нагревании со щёлочью синяя окраска индиго исчезает и образуется вязкая масса. Очистив это вещество, Фрицше получил жидкость с характерным запахом и назвал её анилином (от арабского an-nil «синий»).
В 1841 г русский химик Зинин открыл способ восстановления нитробензола до ароматического амина – бензамида.
Николай Николаевич Зинин − выдающийся русский химик-органик, академик Петербургской академии наук, первый президент Русского химического общества.
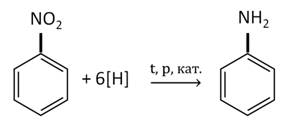
Анилин в лаборатории получают восстановлением нитробензола железом в присутствии соляной кислоты.
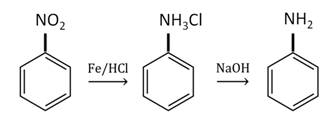
В промышленности анилин получают по реакции Зинина, то есть восстановлением нитробензола. Эта реакции идёт под давлением в присутствии катализаторов.
Анилин находит широкое применение. Его используют для синтеза красителей, лекарств и взрывчатых веществ.
Анилин влияет на центральную нервную систему, вызывает кислородное голодание организма за счет образования в крови метгемоглобина, гемолиза и дегенеративных изменений эритроцитов. В организм анилин попадает во время дыхания, в виде паров, а также через кожу и слизистые оболочки. Всасывание через кожу усиливается в случае нагрева воздуха или употребление алкоголя.
В случае легкого отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин и ногтей. В случае отравлений средней тяжести также наблюдаются тошнота, рвота, иногда шатание во время ходьбы, учащение пульса. Тяжелые случаи отравления являются крайне редкими.
В случае хронического отравления анилином возникают токсический гепатит, а также нервно-психические расстройства, расстройства сна, ухудшение памяти.
В случае отравления анилином необходимо прежде всего вывести пострадавшего из очага отравления, обмыть теплой (но не горячей!) водой. Также необходимо вдыхание кислорода с карбогеном. Кроме этого, применяют кровопускание, введение антидотов (метиленовая синь), сердечно-сосудистых средств. Следует обеспечить пострадавшему покой.
Таким образом, представителем ароматических аминов является анилин. Свойства анилина обусловлены наличием аминогруппы и бензольного кольца. Анилин реагирует с кислотами, вступает в реакцию с бромной водой. Получают анилин в промышленности по реакции Зинина. Анилин используют в производстве красителей, лекарств и взрывчатых веществ.
Практическое задание.
Выполнить тесты.
1. Молекулярная формула аминобензола _____и распространенное название ________
2. Анилин – это:
А) ядовитая жидкость;
Б) бесцветная маслянистая жидкость;
В) желтые кристаллы;
Г) ядовитые кристаллы;
3. В основе получения анилина из бензола лежит реакция:
А) нитрования
Б) дегидратации
В) восстановления
Г) гидратации
4. Первая помощь при отравлении анилином:
А) промывание желудка
Б) яичные белки
В) горячий душ и ванна
Г) горячее питье
5. В организм человека анилин может попасть:
А) через дыхательные пути;
Б) через пищеварительный тракт;
В) через кожные покровы;
Г) половым путем.
Критерии оценивания.
Оценка «отлично» - выполнены все задания правильно.
Оценка «хорошо» - выполнены 4 задания правильно.
Оценка «удовлетворительно» - выполнены 3 задания правильно.
Оценка «неудовлетворительно» - выполнены менее 3 заданий.
Уважаемые студенты! Практическое задание необходимо выполнить в рабочей тетради (сфотографировать) или в формате Документа Word. Отправлять для проверки в личные сообщения на страницу ВКонтакте: https://vk.com/id343837166