Тема: Строение атома
Дата: 07.10.2020 (1 час)
Цель:
рассмотреть строение ядра и электронные конфигурации атома.
Задачи:
познакомить с моделями атома Томсона и Резерфорда, изучить планетарную модель атома, состав атома и атомного ядра.
Студенты должны знать: планетарную модель атома, состав атома и атомного ядра.
Студенты должны уметь: определять состав атома, состав ядра атома по периодической системе химических элементов.
План.
1. Модель атома Томпсона.
2. Ядерная модель атома Резерфорда.
3. Основные характеристики элементарных частиц.
4. Состав атомных ядер.
5. Понятие «изотопы».
Опорный конспект
На протяжении нескольких тысячелетий пытливый человеческий ум волновал вопрос: «Из чего сделан мир?». С тех пор как древние греки все существующее пытались свести к четырем «стихиям» (вода, воздух, земля, и огонь), немало различных картин мира сменили друг друга. Однако, вера в то, что физический мир можно построить путем из небольшого числа некоторых первичных сущностей, или «элементов», никогда не покидали людей…И как вам известно, уже в V в. до н.э. Демокрит пришел к идее о существовании атома.
«Из маленьких атомов мира творенье, из атомов – букв состоят сочинения».
Составляя свою периодическую систему, Д.И. Менделеев расположил все элементы по возрастанию массового числа, но есть противоречия, которые он объяснить не мог. Например: Ar и K, Te и I. Почему? Нужна была новая теория, которая бы объяснила эти противоречия. На помощь пришла физика. Ученые физики предложили теорию строения атома.
Модель атома Томсона
1897 году Томсон открыл электрон, частицу, входящую в состав атома. В 1903 году им был сделан вывод о сложном строении атома и разработана его модель. Согласно этой модели: атом - это шар, по всему объему которого равномерно распределен положительный заряд. Внутри шара находятся отрицательно заряженные электроны. Атом в целом нейтрален: положительный заряд шара равен по модулю суммарному отрицательному заряду электронов. Эта модель получила название «ПУДИНГОВОЙ МОДЕЛИ», так как электроны были вкраплены в положительно заряженную среду, подобно изюму в пудинге.
Модель Томсона казалось привлекательной с той точки зрения, что предполагала наличие электронов в атоме. Однако она просуществовала только до 1911 года.
Ядерная модель атома Резерфорда
Резерфорд предложил ядерную «планетарную» модель атома:
· атомы любого элемента состоят из положительно заряженной части, получившей название ядра;
· в состав ядра входят положительно заряженные элементарные частицы - протоны (позднее было установлено, что и нейтральные нейтроны);
· вокруг ядра вращаются электроны, образующие так называемую электронную оболочку.
Таким образом, на сегодня известно, что в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны. Было установлено, что заряды ядер атомов химических элементов численно равны их порядковому номеру в периодической системе Д.И. Менделеева.
На сегодня известно, что в состав атома входят протоны, нейтроны и электроны, основные характеристики этих частиц представлены в таблице
Таблица элементарных частиц
| Название частицы | Обозначение частицы | Заряд частицы | Масса частицы | ||
| в эл. зарядах | в Кл | в а. е. м. | в кг | ||
| Электрон | е | -1 | -1,6 . 10-19 | 9,1 . 10-31 | |
| Протон | р | +1 | +1,6 . 10-19 | 1,6 . 10-27 | |
| Нейтрон | п | 1,6 . 10-27 |
Строение всех атомов зашифровано в периодической системе химических элементов Д. И. Менделеева. Вы, знаете, что каждому химическому элементу присвоен порядковый номер и для каждого элемента подсчитана атомная масса. Но это не просто числа, они имеют физический смысл. В чем он заключается, мы сейчас узнаем.
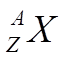 |
Введем обозначение химического элемента:
Х - символ химического элемента
Z - порядковый номер элемента
А r - относительная атомная масса элемента
Ar = Z + N
Z соответствует числу протонов и электронов
N соответствует числу нейтронов
Например: условное обозначение ядра атома кислорода:
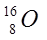 (8р, 8n) 8ē
(8р, 8n) 8ē
Изучение состава атомных ядер привело к открытию изотопов
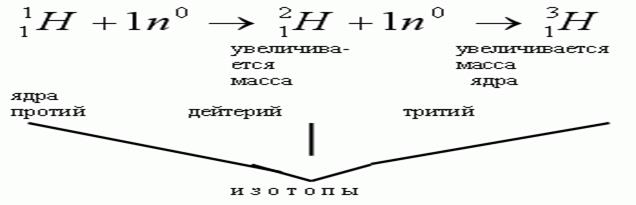
Изотопы – это разновидности атомов данного элемента, обладающие одинаковым числом протонов, но разным числом нейтронов, называются изотопами.
Вопросы для самоконтроля:
1. В чем суть ядерной «планетарной» модели атома?
2. Какие элементарные частицы вам известны?
3. Что такое изотопы?
Практическое задание.
Тест на тему «Строение атома»
1. Положительно заряженная частица называется
А) электрон Б) протон В) нейтрон
2. Отрицательно заряженная частица называется…
А) электрон Б) протон В) нейтрон
3. Частица, не имеющая заряд, называется…
А) электрон Б) протон В) нейтрон
4. Ядро атома состоит из
А) протонов и электронов Б) нейтронов В) нейтронов и протонов
5. Вокруг ядра вращаются…
А) электроны Б) нейтроны В) протоны
6. В переводе с греческого «атом» означает:
А) простейший Б) неделимый В) мельчайший
7. Заряд ядра атома серы равен:
А) +3 Б) +26 В) +16
8. Ядро атома лития состоит из 3 протонов и 4 нейтронов. Сколько вокруг ядра вращается электронов?
А) 3 Б) 4 В) 0
Уважаемые студенты! Практическое задание необходимо выполнить в рабочей тетради (сфотографировать) или в формате Документа Word. Отправлять для проверки в личные сообщения на страницу ВКонтакте: https://vk.com/id343837166