Тема: Алкены
Дата: 08.10.2020 (1 час)
Цель:
дать характеристику непредельных углеводородов.
Задачи: изучить алкены как самостоятельный класс непредельных углеводородов, развивая знания о кратной двойной связи между атомами углерода; рассмотреть гомологию, изомерию и номенклатуру алкенов; изучить химические свойства алкенов, правило Марковникова, познакомить с промышленными и лабораторными способами получения.
Студенты должны знать: о бщую формулу алкенов, физические и химические свойства, способы получения и области применения углеводородов ряда этилена.
Студенты должны уметь: записывать молекулярные, структурные и электронные формулы этиленовых; называть вещества ряда этилена по систематической номенклатуре и по названию записывать формулы.
План.
1. Строение алкенов.
2. Гомологический ряд этилена.
3. Изомерия и номенклатура.
4. Получение:
4.1. Промышленные способы
4.2. Лабораторные способы
5. Свойства:
5.1. Физические свойства
5.2. Химические свойства.
6. Применение.
Опорный конспект
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены).
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле С п Н2 п .
Строение
Атомы углерода, между которыми имеется двойная связь, находятся в состоянии sр2 -гибридизации. Это означает, что в гибридизации участвуют одна s- и две р -орбитали, а одна р -орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р -орбиталей соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π-связи.
Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π-связь, располагаются перпендикулярно плоскости молекулы.
Двойная связь является более прочной. Наличие π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Гомологический ряд этилена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
С2Н4 – этен,
С3Н6 – пропен,
С4Н8 – бутен
С5Н10 – пентен,
С6Н12 — гексен и т.д.
Изомерия и номенклатура
Для алкенов, так же как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен.

Особым видом структурной изомерии является изомерия положения двойной связи.

Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, цис-, или транс -изомерии, которые отличаются друг от друга пространственным расположением фрагментов молекулы относительно плоскости π-связи, а следовательно, и свойствами.

Алкены изомерны циклоалканам (межклассовая изомерия), например:
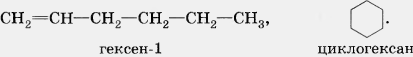
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, - ен.
Получение
4.1. Промышленные способы получения алкенов основаны на превращении алканов в алкены с использованием природных источников УВ (нефть, природный газ).
1. Крекинг нефтепродуктов.
В процессе термического крекинга предельных углеводородов наряду с образованием алканов происходит образование алкенов, например:
C16H34 → t С8Н18 + С8Н16.
гексадекан октан октен
2. Дегидрирование алканов.
При пропускании алканов над катализатором (Pt, Ni, Cr2О3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена.
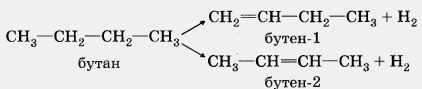
Лабораторные способы.
1. Дегидратация спиртов (отщепление воды).
Воздействие водоотнимающих средств (H2SО4, Аl2О3) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:
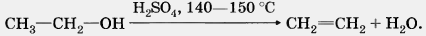
Эту реакцию называют внутримолекулярной дегидратацией.
2. Дегидрогалогенирование галогеналканов.
При взаимодействии галогеналкана с щелочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода:
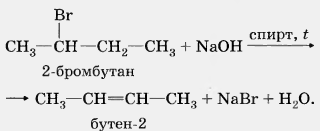
В результате этой реакции образуется преимущественно бутен-2, а не бутен-1, что соответствует правилу Зайцева:
при отщеплении галогеноводорода от вторичных и третичных галогеналканов атом водорода отщепляется от наименее гидрированного атома углерода.
3. Дегалогенирование.
При действии цинка или магния на дибромпроизводное алкана происходит отщепление атомов галогенов, находящихся при соседних атомах углерода, и образование двойной связи:
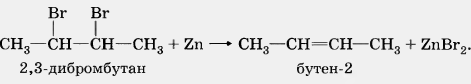
Свойства
Физические свойства
Первые три представителя гомологического ряда алкенов — газы, вещества состава С5Н10—С16Н32 — жидкости, высшие алкены — твердые вещества. Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства
1. Реакции присоединения.
а) Гидрирование алкенов.
Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:
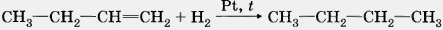
б) Галогенирование.
Взаимодействие алкена с бромной водой или раствором брома в органическом растворителеприводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов:
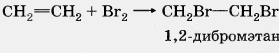
в) Гидрогалогенирование:
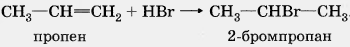
Реакция присоединения галогеноводорода более подробно будет рассмотрена ниже. Эта реакция подчиняется правилу Марковникова: при присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, а галоген к менее гидрированному.
г) Гидратация. Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
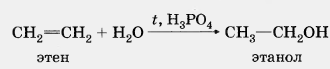
Первичный спирт образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты:
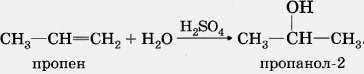
2. Полимеризация
Особым случаем реакции присоединения является реакция полимеризации алкенов и их производных. Реакция протекает при повышенной температуре и давлении, а также в присутствии катализатора:
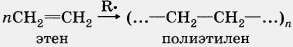
3. Реакции окисления
а) Горение
Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
С2Н4 + 2О2 → 2СО2 + 2Н2О
б) Окисление перманганатом калия (реакция Вагнера)
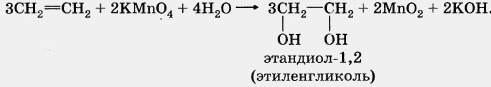
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием водных растворов перманганата калия. В нейтральных или слабощелочных растворах на холоду происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
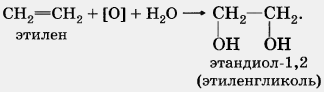
В действительности процесс окисления алкенов гораздо сложнее, происходящие при этом превращения можно изобразить уравнением:
Применение
Алкены широко используются в химической промышленности как сырье для получения разнообразных органических веществ и материалов. Например, этен — исходное вещество для производства этанола, этиленгликоля, эпоксидов, дихлорэтана.
Большое количество этена перерабатывается в полиэтилен, который используется для изготовления упаковочной пленки, посуды, труб, электроизоляционных материалов.
Из пропена получают глицерин, ацетон, изопропиловый спирт, растворители. Полимеризацией пропена получают полипропилен, который по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.
В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Так, например, волокно из полипропилена прочнее всех известных синтетических волокон. Материалы, изготовленные из этих волокон, являются перспективными и находят все большее применение в разных областях человеческой деятельности.
Практическое задание.
1. Какая структурная особенность отличает непредельные углеводороды от предельных? Приведите примеры подобных соединений.
2. Как происходит образования σ-связи, а как π-связи? Какие связи являются менее прочными и почему? Укажите качественную реакцию для определения π-связи.
3. Напишите структурные формулы следующих алкенов: а) пропен, б) бутен-1, в) 3,3-диметилбутен-1, г) 2,3-диметилпентен-1.
4. Напишите уравнение реакции получения этилена из этанола. Какую роль выполняет концентрированная серная кислота в этой реакции?
Критерии оценивания.
Оценка «отлично» - выполнены все задания правильно.
Оценка «хорошо» - допущена 1 ошибка.
Оценка «удовлетворительно» - допущены 2 ошибки.
Оценка «неудовлетворительно» - допущено более 2 ошибок.
Уважаемые студенты, практическое задание необходимо выполнить в рабочей тетради (сфотографировать) или в формате Документа Word. Отправлять для проверки в личные сообщения на страницу ВКонтакте: https://vk.com/id343837166 Преподаватель: Острик Марина Григорьевна