Октября 2020 г. (пятница)
Дисциплина: Химия
Группа: № 78
Урок № 6
Литература: Рудзитис Г. Е. Химия. 11 класс: учеб. для общеобразоват. организаций с прил. на электрон. носителе базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 2014. – 224 с.
Материалы урока:
Повторить теоретический материал стр. 25-29
Видеоурок https://www.youtube.com/watch?v=SMIab4zd8-A
Тема: Физические свойства аминов.
Цели урока: Сформировать представление об аминах, их физических свойствах.
Задачи:
Образовательная:
· рассмотреть классификацию аминов;
· изучить физические свойства.
Воспитательная:
· воспитание познавательного интереса к предмету и окружающим явлениям.
Развивающая:
· развитие способности к самоорганизации.
Амины – это производные аммиака, в которых один или несколько атомов водорода замещены на углеводородный радикал.
Классификация аминов
Физические свойства аминов
Раньше низшие амины путали с аммиаком, так как имеют резкий запах.
Итак, низшие амины – это газы с резким запахом;
Средние амины и анилин – это жидкости;
Высшие амины – твёрдые вещества.
С увеличением молекулярной массы амина температура кипения и растворимость в воде уменьшается.
Метиламин, диметиламин и триметиламин — газы, средние члены алифатического ряда - жидкости, высшие — твердые вещества. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
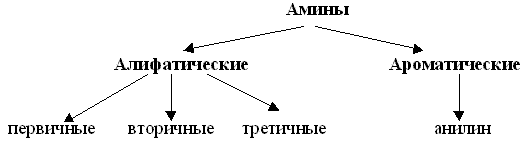
Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).
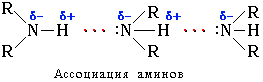
Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
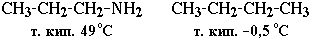
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения (т. кип. метиламина -6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность водородных связей с атомом азота меньше, чем с участием более электроотрицательного кислорода.
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
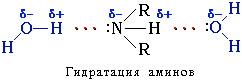
Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов:
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
Анилин 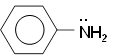
Некоторые другие ароматические амины
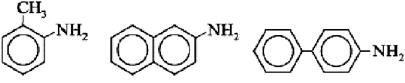
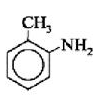
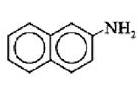
орто-толуидин 2-нафтиламин 4-аминобифенил
| 
| 
|
| орто-толуидин | 2-нафтиламин | 4-аминобифенил |
Ароматические амины
Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны.
Особые свойства анилина
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
1). Для анилина характерны свойства бензольного кольца – действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях:
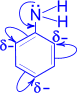
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:
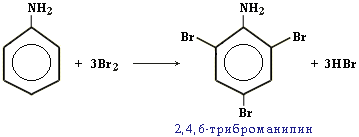
Бромированиеанилина
2). Свойства аминогруппы:
С6Н5NН2 + HCl → [С6Н5NН3 ]+Сl-
хлорид фениламмония
Окисление анилина раствором хлорной извести – качественная реакция
Взаимодействие анилина с дихроматом калия – получение красителей.
Домашнее задание (ответьте на вопросы):
1.Какие соединения называются аминами?
2.Как классифицируют амины?
3.Каковы физические свойства аминов?
4.Каковы химические свойства анилина?