Выведем кинетическое уравнение и продифференцируем его
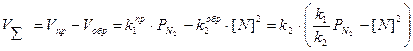
при равновесии 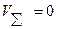
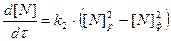
 лимитирует химическое звено
лимитирует химическое звено
где: 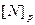 - равновесная концентрация азота, при
- равновесная концентрация азота, при 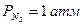 ;
;
 - фактическая концентрация азота.
- фактическая концентрация азота.
Решаем полученное кинетическое уравнение
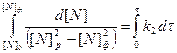
в результате дифференцирования
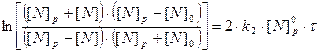
где: 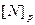 - равновесная концентрация азота, при
- равновесная концентрация азота, при 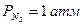 ;
;
 - фактическая концентрация азота;
- фактическая концентрация азота;
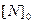 - концентрация азота в начальный момент времени;
- концентрация азота в начальный момент времени;
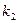 - эффективная константа скорости реакции.
- эффективная константа скорости реакции.
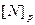 при заданных температурах вычислим, используя уравнение Чипмана-Корригана
при заданных температурах вычислим, используя уравнение Чипмана-Корригана
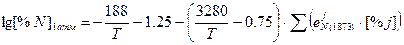
для стали 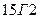 ([C]=0.15%, [Mn]=2%, другими элементами в виду их малой концентрации пренебрегаем)
([C]=0.15%, [Mn]=2%, другими элементами в виду их малой концентрации пренебрегаем)
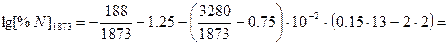
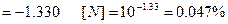
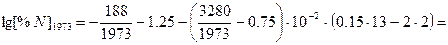
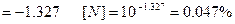
Для упрощения обозначим 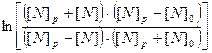 , как
, как 
Строим график зависимости  от
от 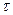 для двух температур (рис. 1-3).
для двух температур (рис. 1-3).
Таблица 1.2.
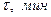
| ||||||
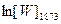
| 0.3974 | 0.8446 | 1.0150 | 1.3400 | 1.7512 | |
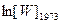
| 0.5385 | 1.0150 | 1.3400 | 1.8503 | 2.3494 |
Определить эффективную энергию активации процесса, можно зная константу скорости  при двух температурах. (подробнее см. задачу №3)
при двух температурах. (подробнее см. задачу №3)
Константу скорости найдем по угловому коэффициенту прямой 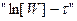
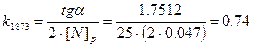
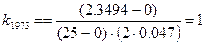
Тогда
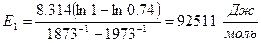
Пусть процесс лимитируется в целом внутренним массопереносом.
Запишем кинетическое уравнение
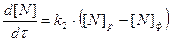
В результате аналогичных рассуждений (см. выше) получим

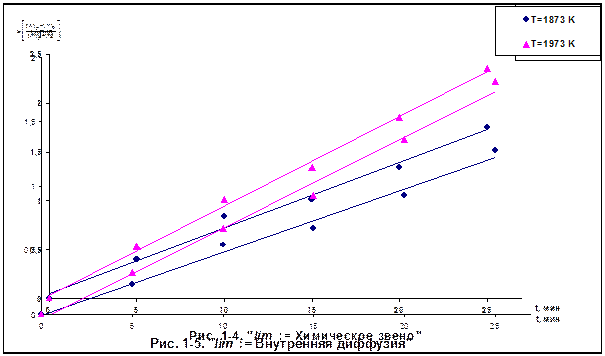
Строим график зависимости 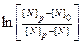 , от
, от 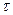 для двух температур (рис. 1-4).
для двух температур (рис. 1-4).
Таблица 1.3.
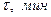
| ||||||

| 0.2348 | 0.5423 | 0.6702 | 0.9280 | 1.2763 | |
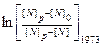
| 0.3272 | 0.6702 | 0.9280 | 1.3633 | 1.8153 |
Определим энергию активации
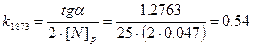
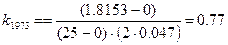
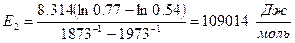
 |
Графически нельзя определить в каких координатах опытные данные ложатся на прямую линию. Для сравнения используем коэффициент корреляции 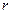 (см. регрессионный анализ). Связь лучше, при большем значении
(см. регрессионный анализ). Связь лучше, при большем значении 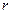 .
.
Таблица 1.4.
| Гипотеза о лимитирующем звене | Признаки, определяющие химическое звено | ||
| Вид кинетической кривой (значение коэффициента корреляции) | Значение эффективной энергии активации | ||
| Химико-адсорбционный акт | 
| 0.9943 | 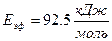
|
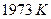
| 0.9982 | ||
| Внутренняя диффузия | 
| 0.9942 | 
|
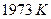
| 0.9960 |
Исходя из данных таблицы 1.4. можно предположить, что процесс растворения азота в жидкой стали при данных температурах, скорее всего протекает в смешанном режиме, который в свою очередь преимущественно определяется внутренней диффузией.
Задача № 2
Железоуглеродистый расплав обдувают кислород содержащей газовой смесью с постоянным расходом кислорода 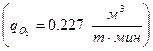 . Провести кинетический анализ процесса обезуглероживания металла; определить константы скорости, энергию активации и лимитирующее звено процесса.
. Провести кинетический анализ процесса обезуглероживания металла; определить константы скорости, энергию активации и лимитирующее звено процесса.
Исходные данные.
Результаты проб металла на содержание углерода (%), отобранных по ходу кислородной продувки на двух плавках, проведенных при температурах  и
и 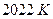
Таблица 3.1.
Т-ра, 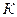
| Содержание углерода (%) во времени (мин) | |||||||||||
| 0.899 | 0.75 | 0.601 | 0.451 | 0.313 | 0.215 | 0.148 | 0.1 | 0.069 | 0.048 | 0.032 | ||
| 0.899 | 0.731 | 0.562 | 0.395 | 0.235 | 0.135 | 0.078 | 0.045 | 0.026 | 0.015 | - |
Теория.
При обдуве железоуглеродистого расплава газообразным кислородом идет процесс окисления углерода, общая балансовая схема которого может быть представлена уравнением

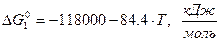 (3.1)
(3.1)
Непосредственное взаимодействие углерода и кислорода происходит, когда оба реагента находятся в растворенном состоянии
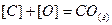
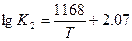 (3.2)
(3.2)
Обезуглероживание является гетерогенным процессом и может быть представлено совокупностью ряда последовательных стадий, главными из которых являются следующие:
1. Внешний массоперенос кислорода в газовой фазе – доставка газообразного кислорода в зону реакции.
2. Внутренний массоперенос растворенного в металле углерода.
3. Химико-адсорбционное звено, отражаемое реакцией (3.2). Структура этой стадии представляется достаточно сложной и включает, по крайней мере, три следующие подстадии:
а) адсорбцию 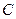 и
и 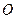 на поверхности «металл-газ».
на поверхности «металл-газ».
б) химическое взаимодействие 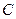 и
и 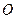 с образованием
с образованием 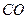 .
.
в) десорбция 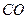 в газовой фазе.
в газовой фазе.
4. Массоперенос 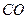 в газовой фазе.
в газовой фазе.
Для реальных условий сталеплавильного процесса концентрации углерода и кислорода в расплаве таковы, что равновесное с ними давление 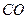

равно атмосферному давлению  либо несколько превышает его:
либо несколько превышает его:
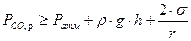
где: 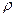 - плотность жидкого металла;
- плотность жидкого металла;
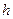 - высота металлической ванны;
- высота металлической ванны;
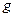 - ускорение свободного падения;
- ускорение свободного падения;
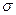 - поверхностное натяжение стали;
- поверхностное натяжение стали;
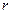 - радиус пузырьков
- радиус пузырьков 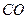 .
.
Величины гидростатического 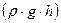 и капиллярного
и капиллярного 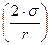 давления учитываются при обезуглероживании ванны в режиме пузырькового кипения, когда пузырьки
давления учитываются при обезуглероживании ванны в режиме пузырькового кипения, когда пузырьки  образуются на подине ванны.
образуются на подине ванны.
Так как давление образующегося  превышает внешнее, то массоперенос
превышает внешнее, то массоперенос  в газовой фазе происходит достаточно быстро и стадия 4 не лимитирует процесс в целом.
в газовой фазе происходит достаточно быстро и стадия 4 не лимитирует процесс в целом.
В зависимости от условий процесса лимитировать его может какая-то одна из первых трех стадий. Может наблюдаться смешанный контроль, когда сопротивления отдельных стадий оказываются соизмеримыми и ни одним из них нельзя пренебречь.
При высоких температурах, характерных для металлургических процессов, скорость непосредственного химического взаимодействия реагентов оказывается довольно большой величиной и обычно не лимитирует процесс обезуглероживания в целом. Лимитирующими звеньями в этом случае могут быть процессы массопереноса.
Достаточно хорошо объясняет экспериментальные данные (как лабораторные, так и промышленные) теория критических концентраций, разработанная С. И. Филипповым. Согласно этой теории при концентрациях углерода, превышающих некоторую критическую 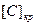 , скорость обезуглероживания лимитируется доставкой окислителя – в данном случае внешним массопереносом кислорода в газовой фазе. При концентрации углерода ниже критической скорость процесса определяется массопереносом растворенного в металле углерода (внутренним массопереносом).
, скорость обезуглероживания лимитируется доставкой окислителя – в данном случае внешним массопереносом кислорода в газовой фазе. При концентрации углерода ниже критической скорость процесса определяется массопереносом растворенного в металле углерода (внутренним массопереносом).
Таким образом, для 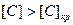 кинетическое уравнение имеет вид
кинетическое уравнение имеет вид
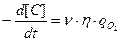 (3.3)
(3.3)
где: 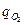 - удельный расход кислорода, выраженный, например, в
- удельный расход кислорода, выраженный, например, в  ;
;
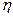 - степень усвоения газообразного кислорода металлической ванной
- степень усвоения газообразного кислорода металлической ванной 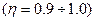 ;
;
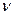 - коэффициент, определяемый стехиометрией реакции (3.1). При
- коэффициент, определяемый стехиометрией реакции (3.1). При 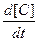 и
и 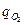 , выраженных соответственно в
, выраженных соответственно в 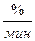 и
и  ,
, 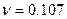 .
.
Если в ходе обезуглероживания 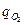 и
и 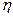 не изменяются, то произведение
не изменяются, то произведение 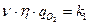 остается постоянной величиной и уравнение (3.3) приобретает вид кинетического уравнения нулевого порядка относительно концентрации углерода
остается постоянной величиной и уравнение (3.3) приобретает вид кинетического уравнения нулевого порядка относительно концентрации углерода
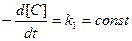 (3.4)
(3.4)
Интегрирование уравнения (3.4) от начальной концентрации 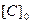 до текущей
до текущей 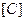 и по времени от 0 до
и по времени от 0 до 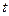 дает решение
дает решение
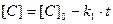 (3.5)
(3.5)
Уравнения (3.4) и (3.5) показывают, что при 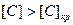 кинетическая кривая «
кинетическая кривая « » имеет вид прямой линии, что отвечает постоянству скорости обезуглероживания. Величину
» имеет вид прямой линии, что отвечает постоянству скорости обезуглероживания. Величину 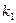 можно определить графически (рис. 3-1), как угловой коэффициент прямолинейного участка кривой
можно определить графически (рис. 3-1), как угловой коэффициент прямолинейного участка кривой  . Так как при
. Так как при 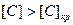 скорость обезуглероживания определяется массопереносом углерода в ванне металла, то кинетическое уравнение имеет вид
скорость обезуглероживания определяется массопереносом углерода в ванне металла, то кинетическое уравнение имеет вид
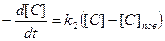 (3.6)
(3.6)
где: 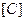 и
и 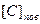 - концентрации углерода соответственно в объеме ванны и у
- концентрации углерода соответственно в объеме ванны и у
границы раздела «металл-газ-шлаковая фаза», где происходит реакция;
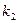 - константа скорости стадии 2.
- константа скорости стадии 2.
При 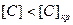 , когда доставка кислорода не лимитирует процесс, поверхность металла насыщается кислородом, и на ней образуются оксиды железа
, когда доставка кислорода не лимитирует процесс, поверхность металла насыщается кислородом, и на ней образуются оксиды железа 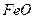
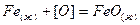
 (3.7)
(3.7)
при  например, концентрация кислорода, рассчитанная по реакции (3.3), равна
например, концентрация кислорода, рассчитанная по реакции (3.3), равна 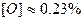 , при наличии
, при наличии 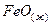 .
.
Если скорость процесса лимитируется массотдачей, это дает основание считать, что на межфазной поверхности, где протекает реакция, успевает установиться локальное равновесие. Тогда поверхностная концентрация углерода 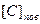 в реакционной зоне определенная из условия равновесия реакции (3.2) при
в реакционной зоне определенная из условия равновесия реакции (3.2) при  и
и 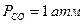 , равна
, равна 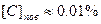 . То есть, при концентрации углерода
. То есть, при концентрации углерода 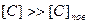 величиной
величиной 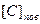 в уравнении (3.6) можно пренебречь, тогда
в уравнении (3.6) можно пренебречь, тогда
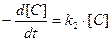 (3.8)
(3.8)
Интегрирование дифференциального уравнения (3.8) в пределах от 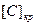 до
до 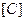 и от
и от 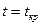 до
до 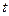 дает следующее решение
дает следующее решение
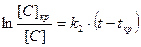
или  (3.9)
(3.9)
В уравнении (3.9) выражение в скобках, при неизменных 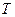 и
и 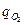 является постоянной величиной. Это позволяет согласно (3.9) найти
является постоянной величиной. Это позволяет согласно (3.9) найти 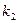 и
и 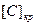 из графика «
из графика « » (рис. 3-2). Здесь
» (рис. 3-2). Здесь 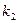 - угловой коэффициент прямолинейного участка кривой - «
- угловой коэффициент прямолинейного участка кривой - « », отвечающего большим временам и малым
», отвечающего большим временам и малым 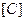 ; излом этой прямой наблюдается при
; излом этой прямой наблюдается при 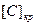 и
и 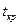 .
.
Величину 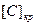 можно вычислить также из условия равенства скоростей обезуглероживания, определяемых уравнениями (3.4) и (3.8) в точке
можно вычислить также из условия равенства скоростей обезуглероживания, определяемых уравнениями (3.4) и (3.8) в точке 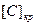
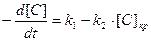
откуда  (3.10)
(3.10)
По формуле (3.10) величину 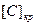 можно определить более точно, чем непосредственно из графиков рис. 3-1, 3-2.
можно определить более точно, чем непосредственно из графиков рис. 3-1, 3-2.
Энергию активации процесса  можно определить, зная значения константы скорости
можно определить, зная значения константы скорости  хотя бы при двух температурах
хотя бы при двух температурах  и
и 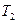 . Тогда можно записать систему уравнений
. Тогда можно записать систему уравнений
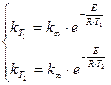 (3.11)
(3.11)
решив которую получим
 (3.12)
(3.12)
Если вычисленное 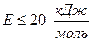 , это свидетельствует в пользу того, что процесс лимитируется внешним массопереносом в газовой фазе – доставкой кислорода к поверхности металла. Величина
, это свидетельствует в пользу того, что процесс лимитируется внешним массопереносом в газовой фазе – доставкой кислорода к поверхности металла. Величина 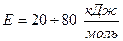 отвечает лимитированию процесса внутренним массопереносом в металле. При
отвечает лимитированию процесса внутренним массопереносом в металле. При 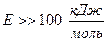 процесс, скорее всего, протекает в кинетическом (лимитирует стадия 3) либо в смешанном режиме.
процесс, скорее всего, протекает в кинетическом (лимитирует стадия 3) либо в смешанном режиме.
Решение
1. Построим кинетические кривые  при двух указанных температурах
при двух указанных температурах 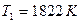 и
и 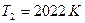 (см. рис. 3-1). Из рисунка 3-1 видно, что кинетические кривые отклоняются от прямой при критических концентрациях углерода
(см. рис. 3-1). Из рисунка 3-1 видно, что кинетические кривые отклоняются от прямой при критических концентрациях углерода 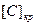 , лежащих в интервале от 0.25 до 0.45%. Значения
, лежащих в интервале от 0.25 до 0.45%. Значения 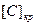 далее будут уточнены (см. рис. 3-2, 3-3 и формулу (3.10)).
далее будут уточнены (см. рис. 3-2, 3-3 и формулу (3.10)).
2. Определим графически из рис. 3-1 значения константы скорости 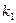 , при 1822
, при 1822 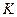 и 2022
и 2022 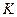 для высоких концентраций углерода
для высоких концентраций углерода 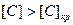
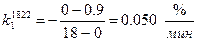 ;
; 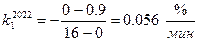
3. Энергию активации процесса обезуглероживания при 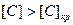 найдем по
найдем по
формуле (3.12)

Независимость скорости обезуглероживания от концентрации углерода, ее постоянство при высоких 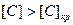 , а также величина энергии активации
, а также величина энергии активации 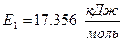 , находящаяся в интервале энергий активаций, характерных для внешнедиффузионного контроля
, находящаяся в интервале энергий активаций, характерных для внешнедиффузионного контроля 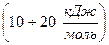 , говорят о том, что до
, говорят о том, что до  процесс определяется внешним массопереносом – доставкой газообразного кислорода в зону реакции.
процесс определяется внешним массопереносом – доставкой газообразного кислорода в зону реакции.
4. Отложим на графике значения 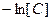 , против
, против 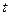 (см. рис. 3-1)
(см. рис. 3-1)
| Таблица 3.2. | ||||||||||||
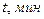
| ||||||||||||
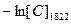
| 0.106 | 0.288 | 0.509 | 0.796 | 1.162 | 1.537 | 1.911 | 2.303 | 2.674 | 3.037 | -3.44 | |

| 0.106 | 0.313 | 0.576 | 0.929 | 1.448 | 2.002 | 2.551 | 3.101 | 3.65 | 4.2 | - |
Из рис. 3-2 видно, что уравнение (3.9), отвечающее лимитированию процесса внутренним массопереносом, хорошо описывает экспериментальные данные для больших времен и малых 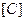 - прямолинейный участок кривых «
- прямолинейный участок кривых «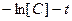 ». Излом прямых «
». Излом прямых «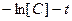 » происходит при
» происходит при 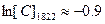 и
и 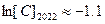 , что отвечает
, что отвечает 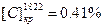 и
и 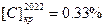 .
.
Значения константы скорости 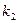 определили графически, как угловой коэффициент прямолинейного участка кривой «
определили графически, как угловой коэффициент прямолинейного участка кривой «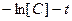 »
»
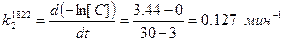
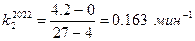
5. Значения критических концентраций углерода  отвечающих переходу от внешне диффузионного контроля к внутри диффузионному, более точно можно определить по формуле (3.10).
отвечающих переходу от внешне диффузионного контроля к внутри диффузионному, более точно можно определить по формуле (3.10).

6. Вычислим энергию активации процесса при 
что отвечает энергии активации диффузии компонентов в жидком железе, которая обычно лежит в интервале от 20000 до 80000  .
.
Таким образом, анализ кинетики процесса обезуглероживания железоуглеродистого расплава показывает, что при высоких концентрациях углерода, превышающих критические, процесс протекает во внешнедиффузионной области, то есть, контролируется внешним массопереносом – доставкой газообразного углерода в зону реакции. При низких концентрациях углерода, меньших критической  , процесс обезуглероживания контролируется внутренним массопереносом углерода в жидком железе.
, процесс обезуглероживания контролируется внутренним массопереносом углерода в жидком железе.
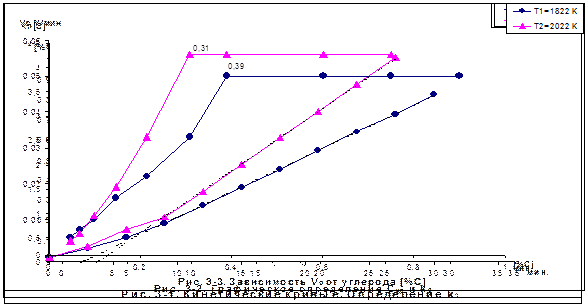
Наглядное представление о критических концентрациях углерода можно получить из рис. 3-3, который представляет зависимость скорости обезуглероживания от концентрации углерода в расплаве во внешне и внутридиффузионной областях. Графики рис. 3-3 могут быть построены по значениям  и
и 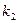 . Из рис. 3-3 видно, что до
. Из рис. 3-3 видно, что до  скорость обезуглероживания постоянна
скорость обезуглероживания постоянна 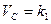 (внешнедиффузионная область), а при
(внешнедиффузионная область), а при 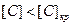 она прямо пропорциональна концентрации углерода
она прямо пропорциональна концентрации углерода 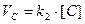 (внутридиффузионная область).
(внутридиффузионная область).
 |