Вода является слабым электролитом и частично диссоциирует на ион водорода Н+ и гидроксид-ион ОН-:

 Н2О Н+ + ОН-.
Н2О Н+ + ОН-.
Концентрация ионов Н+ и ОН- одинакова и при 295 К составляет 10-7 моль/ л. Часто вместо концентрации ионов водорода используют водородный показатель рН:
рН = - lg с (Н+). (34)
Очевидно, что для воды при 295 К он равен 7. Произведение молярных концентраций ионов Н+ и ОН- в воде и их разбавленных растворах при данной температуре – величина постоянная и называется ионным произведением воды ( Кв ):
Кв = с (Н+) × с (ОН-); Кв = 10–14 при 295 К. (35)
При добавлении к воде кислоты, диссоциирующей на кислотные остатки и ионы водорода, концентрация последних увеличивается, а концентрация гидроксид-ионов уменьшается. Водородный показатель таких кислых сред становится меньше 7. При растворении в воде оснований концентрация анионов ОН- превышает концентрацию Н+, и рН среды становится больше 7. По аналогии с рН введен также показатель рОН, и с учетом (35) выполняется следующее равенство:
рН + рОН = 14. (36)
Концентрация ионов Н+ или ОН- в случае сильных кислот и оснований определяется, во-первых, общей молярной концентрацией кислоты или основания с, во-вторых, числом ионов Н+ или ОН-, образующихся при диссоциации молекулы кислоты или основания; в случае слабых кислот и оснований она определяется также степенью диссоциации. Так, для бинарных слабых кислот и оснований с (Н+) или с (ОН-) будут соответственно равны aс (для сильных бинарных кислот и оснований с (Н+) = с и с (ОН-) = с).
В растворах слабых бинарных электролитов между ионами и недиссоциированными молекулами устанавливается равновесие, константа диссоциации которого КД может быть представлена законом разбавления Оствальда:
КД = a2 с / (1-a). (37)
Если a << 1, то вместо (37) можно использовать (38):
КД = a2 с. (38)
*****
Задача 4. Определить рН и концентрацию ионов ОН- раствора, в 5 л которого содержится 1,83 г хлороводорода.
1) Задача на водородный показатель и ионное произведение воды:
(а) рН = - lg с (Н+),
(б) Кв = с (Н+) × с (ОН-).
2) Определим молярную массу хлороводорода и молярную концентрацию раствора:
М(НС1) = 36,5 г/ моль;
с = m1 / M1V3 = 1,83 г / (36,5 (г/моль) × 5 л) = 0,01 моль/л.
Так как раствор HCl является сильной кислотой, то с (Н+) = с.
3) Определим рН раствора по (а):
рН = - lg10–2 = 2.
4) Определим концентрацию ОН- по (б):
с (ОН-) = 10 –14 / с (Н+) = 10 –14 / 10 –2 = 10 –12 (моль/ л).
Ответ: рН = 2; с (ОН-) = 10 –12 моль/ л.
*****
Задача 5. Раствор слабой одноосновной кислоты имеет концентрацию 0,01 моль/л. Вычислить рН раствора и концентрацию ОН-, если степень диссоциации кислоты равна 0,001.
1) Задача на водородный показатель среды и ионное произведение воды:
(а) рН = - lg с (Н+),
(б) Кв = с (Н+) × с (ОН-).
2) Вычислим молярную концентрацию ионов Н+ и рН раствора:
с (Н+) = aс = 10-3 ×10-2 моль/л = 10-5 моль/ л;
рН = - lg10–5 = 5.
4. Определим концентрацию ОН- :
с (ОН-) = 10 –14 / с (Н+) = 10 –14 / 10 –5 = 10 –9 моль/ л.
Ответ: рН = 5; с (ОН-) = 10 –9 моль/ л.
*****
Задача 6. Вычислить рН одноосновной кислоты, если ее концентрация 0,1 моль/л, а константа диссоциации равна 10-11.
1) Задача на водородный показатель среды и закон разбавления:
(а) рН = - lg с (Н+),
(б) КД = a2 с.
2) По (б) найдем степень электролитической диссоциации:

 a = Ö(КД / с) = Ö(10-11 / 10-1) = 10-5.
a = Ö(КД / с) = Ö(10-11 / 10-1) = 10-5.
3) Рассчитаем молярную концентрацию ионов Н+ и определим рН раствора по (а):
с (Н+) = aс = 10-5 ×10-1 моль/л = 10-6 моль/ л.
рН = - lg10–6 = 6.
Ответ: рН = 6.
*****
Задача 7. Вычислить pH раствора гидроксида бария с эквивалентной концентрацией 0,001 моль/л. Диссоциация полная.
1) Напишем ключевые формулы для решения задачи:
(а) рН = - lg с (Н+),
(б) Кв = с (Н+) × с (ОН-),
(в) c = cэ Mэ/ М.
2) Выразим эквивалентную массу гидроксида бария через молярную массу и кислотность и вычислим молярную концентрацию электролита:
Mэ(1)= М1 / 2,
с = (М1 / 2) × (cэ / М1) = cэ / 2 = 0,001: 2 = 5 × 10–4 (моль/ л).
3) Учитывая уравнение реакции диссоциации гидроксида бария, определим молярную концентрацию ионов ОН-:
Ва(ОН)2 = Ва2+ + 2ОН- ,
С 2с
с (ОН-) = 2с = 2 × 5 × 10–4 моль/ л = 10–3 моль/ л.
4) По (б) и (а) рассчитаем молярную концентрацию с (Н+) и рН:
с (Н+) = 10 –14 / с (ОН-) = 10 –14 / 10 –3 = 10 –11 (моль/ л),
рН = - lg10 –11 = 11.
Ответ: рН = 11.
*****
Задача 8. Вычислить степень и константу диссоциации слабого основания KtОН (Kt - катион), если раствор имеет молярную концентрацию 0,001 моль/л и рН = 9.
1) Напишем ключевые формулы для решения задачи:
(а) рН = - lg с (Н+),
(б) Кв = с (Н+) × с (ОН-),
(в) КД = a2 с.
2) По формулам (а) и (б) определим концентрацию ионов ОН- в растворе:
с (Н+) = 10 –9 моль / л,
с (ОН-) = 10 –14 / с (Н+) = 10–14 / 10–9 = 10–5 моль/ л.
3) Учитывая уравнение равновесной реакции диссоциации основания, определим концентрацию ионов ОН- и степень электролитической диссоциации:
МеОН = Ме+ + ОН- ,
(1-a)с aс aс
с (ОН-) = aс,
a = с (ОН-) / с = 10-5 / 10-3 = 10-2.
4) Используя формулу (в), найдем константу диссоциации основания:
КД = a 2 с = (10-2) 2. 10-3 = 10-7.
Ответ: a = 10-2; КД = 10-7.
*****
Реакции между ионами
При смешивании растворов электролитов между ионами могут протекать реакции с образованием осадков, газов или молекул слабых электролитов. Для определения возможности протекания подобных реакций следует пользоваться таблицами растворимости веществ (Приложение 2) и констант диссоциации слабых электролитов (Приложение 3), а также учитывать, что почти все соли являются сильными электролитами. Реакции между ионами протекают, в частности, при нейтрализации кислот и оснований, в результате чего образуются соли и вода. Если кислота и основание сильные, то равновесие практически полностью сдвинуто в сторону образования воды – слабого электролита (раствор будет нейтральным):
 KOH + HCl KCl + H2O,
KOH + HCl KCl + H2O,
с с с сл
 H+ + OH- H2O.
H+ + OH- H2O.
Нижние индексы указывают, что вещества являются сильными (с) или слабыми (сл) электролитами. Если кислота или основание слабые, то нейтрализация не протекает до конца и реакция обратима. Например:
 CH3COOH + KOH H2O + KCH3COO,
CH3COOH + KOH H2O + KCH3COO,
сл с сл с
 CH COOH + OH- H2O + CH3COO-.
CH COOH + OH- H2O + CH3COO-.
сл сл
*****
| Задача 9. Напишите молекулярные и ионно - молекулярные уравнения реакций между растворами: 1) сульфида натрия и хлороводорода; 2) этаната (ацетата) калия и азотной кислоты; 3) гидроксида кальция и сульфата натрия. |

 1) Na2S + 2HCl H2S + 2NaCl,
1) Na2S + 2HCl H2S + 2NaCl,
с с сл с

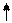 S2- + 2H+ H2S.
S2- + 2H+ H2S.
 2) CH3COOK + HNO3 KNO3 + CH3COOH
2) CH3COOK + HNO3 KNO3 + CH3COOH
c c c cл

 CH3COO- + H+ CH3COOH
CH3COO- + H+ CH3COOH
 3) Ca (OH)2 + Nа2SO4 2NaOH + CaSO4
3) Ca (OH)2 + Nа2SO4 2NaOH + CaSO4
с с

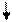 Ca2+ + SO42- CaSO4
Ca2+ + SO42- CaSO4
Все равновесия сильно смещены вправо в соответствии с данными таблиц Приложений 2 и 3.
*****
4. Гидролиз солей
К ионным реакциям относятся реакции гидролиза – обменные взаимодействия солей с водой, в результате которых образуются слабые кислоты или слабые основания, а растворы приобретают соответственно основную или кислотную среду.
Если соль образована слабой кислотой и сильным основанием (верхние индексы «сл» и «с»), то в результате гидролиза образуются молекулы слабой кислоты и гироксид-ионы, а раствор становится основным:
с ï сл
 KCN + H2O HCN + KOH,
KCN + H2O HCN + KOH,
с сл сл с
 CN- + H2O HCN + OH- ,
CN- + H2O HCN + OH- ,
рН > 7.
При гидролизе соли, образованной сильной кислотой и слабым основанием, в молекулы слабого основания связываются катионы соли, а в растворе возрастает концентрация ионов водорода, т.е. он становится кислым:
сл ïс
 NH4Cl + H2O NH4OH + HCl,
NH4Cl + H2O NH4OH + HCl,
с сл сл с
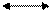 NH4+ + H2O NH4OH + H+ ,
NH4+ + H2O NH4OH + H+ ,
рН < 7.
В случае солей, содержащих анион многоосновной слабой кислоты и катион сильного основания, или катион многокислотного слабого основания и анион сильной кислоты, гидролиз идет не до конца, а ограничивается, как правило, первой или второй ступенью. Например:
с ï сл
 1) Na2S + H2O NaHS + NaOH,
1) Na2S + H2O NaHS + NaOH,
с сл
 S2- + H2O HS- + OH- ,
S2- + H2O HS- + OH- ,
рН > 7.
сл ï с
 2) AlCl3 + H2O Al(OH)Cl2 + НCl,
2) AlCl3 + H2O Al(OH)Cl2 + НCl,
с сл
 Al+3 + H2O Al(OH)2+ + H+ .
Al+3 + H2O Al(OH)2+ + H+ .
Если связать протоны добавлением основания или сильно разбавить раствор, то возможна вторая ступень гидролиза:
 Al(ОH)2+ + H2O Al (OH)2+ + H+ ,
Al(ОH)2+ + H2O Al (OH)2+ + H+ ,
рН < 7.
Соли слабых кислот и слабых оснований полностью гидролизованы в растворе до свободной кислоты и свободного основания:
сл ïсл
 Al2S3 + 6H2O 2Al (OH)3 + 3H2S.
Al2S3 + 6H2O 2Al (OH)3 + 3H2S.
Такие соли в водных растворах существовать не могут. Среда раствора в таких случаях определяется соотношением констант диссоциации слабых электролитов. Во всех случаях при гидролизе реакцию среды определяет более сильный электролит - если это кислота, то среда кислая, если основание, то среда основная, т.к. более слабый электролит при этом связывает в менее или малодиссоциируемые молекулы соответственно либо ионы ОН-, либо ионы Н+.
*****
| Задача 10. Раствор какой соли: NH4Br, K3PO4 или K2SO4 имеет основную среду? Напишите уравнения реакций. |
1) Рассмотрим состав указанных солей с позиций силы электролитов, из которых они получены:
сл | с с | сл с | с
NH4Br, K3PO4, K2SO4 .
2) Раствор K3PO4 имеет основную среду, т.к. только в этой соли анион является остатком слабой кислоты:
 K3PO4 + H2O K2HPO4 + KOH,
K3PO4 + H2O K2HPO4 + KOH,
 PO43- + H2O HPO42- + OH-,
PO43- + H2O HPO42- + OH-,
p H > 7.
3) K2SO4 - соль, образованная сильной кислотой и сильным основанием, гидролизу не подвергается.
4) Катион соли NH4Br связывается при гидролизе в молекулы слабого основания NH4OH, а в растворе остаются ионы водорода (среда кислая):
NH4Br + H2O NH4OH + HBr,
NH4+ + H2O NH4OH + H+,
p H < 7.
*****
Приложение 1
Значения некоторых постоянных
| Постоянная | Обозначение | Значение в СИ и в других системах |
| Число Авогадро | NA | 6,022×1023 моль-1 |
| Атомная единица массы | а.е.м. | 1,66×10-27 кг (1,66×10-24 г) |
| Газовая постоянная | R | 8,31 Дж × моль-1 × К-1 (0,08206 л . атм . К-1 . моль-1) |
| Молярный объем | VM | 22,41×10-3 м3 × моль-1 (22,41 л . моль-1) |
Величины, характеризующие количество вещества
| Величина | Обозначение | Единица измерения |
| Молярная масса | М | кг/моль, г/моль |
| Эквивалентная масса | МЭ | кг/моль, г/моль |
| Молярный объем | VM | м3/моль, л/моль |
| Эквивалентный объем | VЭ | м3/моль, л/моль |
| Количество вещества | n | моль |
| Количество молей эквивалентов | nэ | моль |
| Мольная доля | х | моль/моль |
| Массовая доля | w | кг/кг, г/г |
| Объемная доля | j | л/л, мл/мл |
| Молярная концентрация | с | моль/л |
| Эквивалентная концентрация | сэ | моль/л |
| Массовая концентрация | b | г/л |
| Моляльность | b | моль/кг |
Соотношения между некоторыми внесистемными единицами и единицам СИ
| Величина | Единица | Эквивалент в СИ |
| Объем | литр (л) миллилитр (мл) | 10-3 м3 10-6 м3 |
  Давление Давление
| атмосфера (атм) миллиметр ртутного столба (мм рт. ст.) | 101325 Па (Па = Н/м2) 133,322 Па |
| Энергия, работа, теплота | калория термохимическая (кал) | 4,184 Дж (Дж = Н×м) |
| Температура | t °С | Т = (273 + t) К |
| Масса | грамм (г) | 10-3 кг |
Множители и приставки для образования десятичных кратных и дольных единиц
  Множитель Множитель
| Приставка | Обозначение | |
| международное | русское | ||
| 10-1 | деци | d | д |
| 10-2 | санти | c | с |
| 10-3 | милли | m | м |
| 10-6 | Микро | mk | мк |
| 10-9 | нано | n | н |
| дека | da | да | |
| 102 | гекто | h | г |
| 103 | кило | k | к |
| 106 | мега | M | М |
| 109 | гига | G | Г |
Приложение 2
Растворимость кислот, оснований, солей в воде

| OН- | NO3- | SO42- | I- | Cl- | SO32- | PO43- | CO32- | S2- | HPO42- | Br- |
| H+ | р | р | р | р | р | р | р | р | р | р | |
| K+ | р | р | р | р | р | р | р | р | р | р | р |
| Ba2+ | р | р | н | р | р | н | н | н | - | н | р |
| Na+ | р | р | р | р | р | р | р | р | р | р | р |
| NH4+ | р | р | р | р | р | р | - | р | р | р | р |
| Al3+ | н | р | р | р | р | ? | н | ? | - | ? | р |
| Cr3+ | н | р | р | ? | р | - | н | ? | - | ? | р |
| Fe3+ | н | р | р | ? | р | ? | н | ? | - | ? | р |
| Ni2+ | н | р | р | р | р | н | н | н | н | ? | р |
| Pb2+ | н | р | н | н | м | н | н | н | н | м | м |
| Cu2+ | н | р | р | р | р | ? | н | н | н | ? | р |
| Ag+ | - | р | м | н | н | н | н | н | н | ? | н |
| Ca2+ | м | р | м | р | р | н | н | н | - | м | р |
| Fe2+ | н | р | р | р | р | н | н | н | н | н | р |
| Zn2+ | н | р | р | р | р | м | н | н | н | ? | р |
| Li+ | р | р | р | р | р | р | н | р | р | ? | р |
р - растворим, м – малорастворим, н – нерастворим, “-“ – в водных растворах не существует, “?” – нет достоверных сведений о существовании соединения.
Приложение 3
Константы диссоциации Кд некоторых слабых электролитов в
водных растворах при 298 К
| Электролит | К д |
| Азотистая кислота HNO2 | 4 . 10-4 |
| Аммония гидроксид NH4OH | 1,8 . 10-5 |
| Борная кислота (орто) H3BO3, К д (1) | 5,8 . 10-10 |
| Бромноватистая кислота HOBr | 2,1 . 10-9 |
| Кремниевая кислота H2SiO3, K д (1) K д (2) | 2,2 . 10-10 1,6 . 10-12 |
| Метановая (муравьиная) кислота HCOOH | 1,8 . 10-4 |
| Серная кислота H2SO4, К д (2) | 1,2 . 10-2 |
| Сернистая кислота H2SO3, К д (1) K д (2) | 1,6 . 10-2 6,3 . 10-8 |
| Сероводород H2S, K д (1) К д (2) | 6 . 10-8 1. 10-14 |
| Угольная кислота H2CO3, К д (1) К д (2) | 4,5 . 10-7 4,7 . 10-11 |
| Этановая (уксусная) кислота CH3COOH | 1,8 . 10-5 |
| Хлорноватистая кислота HOCl | 5,0. 10-8 |
| Фосфорная кислота (орто) H3PO4, К д (1) К д (2) К д(3) | 7,5 . 10-3 6,3 . 10-8 1,3 . 10-12 |
| Фтороводород HF | 6,6 . 10-4 |
| Циановодород HCN | 7,9 . 10-10 |
| Диэтановая (щавелевая) кислота H2C2O4, К д (1) К д (2) | 5,4 . 10-2 5,4 . 10-5 |
Список литературы
1. Зайцев О.С. Задачи, упражнения и вопросы по химии: Учебн. пособие для вузов. – М., Химия, 1996. – 432 с., ил.
2. Кузьменко Н.Е., Еремин В.В. Задачник по химии. Для школьников и абитуриентов. – М.: «Экзамен», 1999. – 512 с.
* При использовании формул и уравнений в расчетах все величины должны выражаться в единицах
одной системы, желательно СИ.
* Нижний индекс в скобках указывает на то, что данная величина получена при постоянном объеме в случае (9) и при постоянном давлении в случае (11).
* В термохимии и термодинамике необходимо указывать агрегатное состояние веществ, например:
Н2О (г) – газообразная вода; Н2О (ж) – жидкая вода; Н2О (к) – кристаллическая вода.
** Нижний индекс «р» без скобок означает «реакции».
* Нижние индексы относятся: 1 – к растворенному веществу, 2 – к растворителю. 3 – к раствору.