Тема 70
Амины
Аминами называют такой класс соединений, который представляет собой органические производные аммиака, где атомы водорода замещены органическими группами. В этом классе соединений один или несколько водородных атомов могут быть замещены на углеводородные радикалы.
Отличительным признаком этих соединений является присутствие такого фрагмента, как R–N<, где R – соответствует органической группе.
Амины делятся на различные группы, классификация которых зависит от его признака строения, который взят за его основу.
По числу замещённых атомов водорода амины делятся на первичные, вторичные и третичные. К первичным относятся те, у которых был замещен всего лишь один атом водорода, соответственно, во вторичных из трех атомов замещены два, а в третичном замещены все три атома из трех имеющихся.

Если амины рассматривать по характеру органических групп, то их можно разделить на предельные, непредельные и ароматические:

Если же рассматривать амины по числу NH2-групп в молекуле, то их можно разделить на моноамины, диамины, триамины и т.п.
Номенклатура аминов

Таким образом, к названиям органических групп, которые связаны с азотом, доставляют слово «амин» и располагают их в алфавитном порядке.
Также в составлении названия, правила допускают брать за основу углеводород, который можно рассматривать, как замену аминогруппы. Здесь положение аминов принято указывать благодаря числовому индексу.
Давайте рассмотрим, как это будет выглядеть в записи:

Это читается, как 3-аминопентан. В нем числовые индексы, которые расположены вверху указывают порядок нумерации атомов С. В некоторых случаях для определенных аминов сохранились упрощенные названия:
С6Н5NH2 – анилин, хотя, если следовать правилам номенклатуры, то он называется фениламином.
Также в химии часто используют устоявшиеся названия, которые искажают правильные наименования. Так, например:
Н2NСН2СН2ОН – моноэтаноламин, хотя правильно будет называть 2-аминоэтанол;
или
(ОНСН2СН2)2NH – диэтаноламин, а если использовать правильное название, то это будет звучать, как:
Бис 2-гидроксиэтиламин.
Физические свойства аминов
А теперь давайте рассмотрим физические свойства аминов. Первыми представителями ряда аминов являются метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2. Весь этот ряд аминов являются газами, которые имеют запах аммиака.
Средние члены этого ряда, при увеличении количества атомов в R, превращаются в жидкости. А высшие амины, при увеличении длины цепи R до 10 атомов С кристаллизируются и превращаются в твердые вещества.
А также следует знать, что в высших аминах запах практически отсутствует.
Как мы уже говорили, что простейшие амины имеют резкий запах аммиака и хорошо растворяются в воде. К более сложным аминам относится жидкость, которая имеет запах рыбы.
А вот высшие амины являются твердыми веществами, которые совсем не растворяются в воде и запаха они практически не имеют. Растворимость аминов идет на убыль при увеличении длины цепи и возрастании количества органических групп. То есть, чем выше их молекулярная масса, тем хуже их растворимость в воде.
Химические свойства аминов
А теперь приступим к рассмотрению химических свойств аминов:
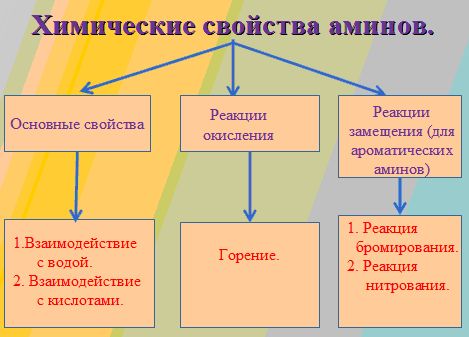
Как правило, общими свойствами органических соединения является их способность к горению. Если сравнивать способность горения аммиака с аминами, то первый горит, но его сложно поджечь. А вот амины имеют свойство легко загораться, и при горении их пламя чаще всего бывает бесцветным.
Рассмотрим пример:

Нахождение аминов в природе
Соединения аминов широко распространены как в растительном, так и в животном мире, а также являются такими биологически активными веществами, как витамины, гормоны, промежуточные продукты обмена веществ.
Также амины встречаются в природе в роли продуктов разложения, так как они образуются при гниении живых организмов. Продукты разложения белков дают запах селедочного рассола. Этот запах сигнализирует о присутствии аминов. В художественной литературе вы могли неоднократно сталкиваться с таким словосочетанием, как «трупный яд» - это также связано с присутствием аминов.
Из-за этого неприятного запаха низшие амины часто путали с аммиаком. Но французский химик Шарль Вюрц в 1849 году обратил внимание на различие между аминами и аммиаком. Оказывается, вся разница в том, что амины обладают способностью к горению на воздухе и при этом образуют углекислый газ.
Применение аминов
Ну а теперь давайте узнаем, где применяются амины? Оказывается, амины нашли широкое применение при изготовлении лекарственных веществ, производстве различных красителей, взрывчатых веществ, а также продуктов, применяемых в органическом синтезе.

Вредное воздействие
Но также, следует знать, что амины – это вещества, которые довольно таки токсичны. Они представляют опасность при вдыхании их паров, а также при контакте с кожным покровом. А такие амины, как, например, анилин, обладает способностью проникновения через кожу в кровь и может нарушить функции гемоглобина, и тем самым привести к летальному исходу.
При попадании аминов в кровь появляются такие симптомы, как одышка, посинение губ, носа и кончиков пальцев. Также при отравлении наблюдается учащенное дыхание и сердцебиение. А в некоторых случаях может дойти и до потери сознания.
В случае отравления или попадания амина на незащищенные участки кожи, необходимо как можно быстрее, очистить пораженный участок кожного покрова с помощью спирта и ваты. Но это следует делать очень аккуратно, стараясь не увеличивать пораженные участки кожи. В случае отравления парами аминов, следует сразу же пострадавшему обеспечить доступ к свежему воздуху и вызвать врача.
При отравлении алифатическими аминами может произойти нарушение функций печени, поражение нервной системы и проницаемости кровеносных сосудов.
Вдыхание ароматических аминов может привести к угнетению центральной нервной системы, а также вызвать рак мочевого пузыря.
Аминокислоты
Среди азотсодержащих органических веществ имеются соединения с двойственной функцией. Особенно важными из них являются аминокислоты.
В клетках и тканях живых организмов встречается около 300 различных аминокислот, но только 20 (α-аминокислоты) из них служат звеньями (мономерами), из которых построены пептиды и белки всех организмов (поэтому их называют белковыми аминокислотами). Последовательность расположения этих аминокислот в белках закодирована в последовательности нуклеотидов соответствующих генов. Остальные аминокислоты встречаются как в виде свободных молекул, так и в связанном виде. Многие из аминокислот встречаются лишь в определенных организмах, а есть и такие, которые обнаруживаются только в одном из великого множества описанных организмов. Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты; животные и человек не способны к образованию так называемых незаменимых аминокислот, получаемых с пищей. Аминокислоты участвуют в обмене белков и углеводов, в образовании важных для организмов соединений (например, пуриновых и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов, антибиотиков и т. д.; некоторые аминокислоты служат посредниками при передаче нервных импульсов.
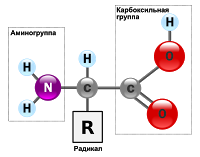
Аминокислоты — органические амфотерные соединения, в состав которых входят карбоксильные группы – СООН и аминогруппы -NH2.
Аминокислоты можно рассматривать как карбоновые кислоты, в молекулах которых атом водорода в радикале замещен аминогруппой.
КЛАССИФИКАЦИЯ

Аминокислоты классифицируют по структурным признакам.
1. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.

2. В зависимости от количества функциональных групп различают кислые, нейтральные и основные.
3. По характеру углеводородного радикала различают алифатические (жирные), ароматические, серосодержащие и гетероциклические аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду.
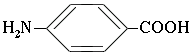
Примером ароматической аминокислоты может служить пара-аминобензойная кислота:
Примером гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота
НОМЕНКЛАТУРА
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы.
Например:

Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Пример:

Для α-аминокислот R-CH(NH2)COOH
, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
Таблица. Некоторые важнейшие α-аминокислоты
| Аминокислота | Сокращённое обозначение | Строение радикала (R) |
| Глицин | Gly (Гли) | H - |
| Аланин | Ala (Ала) | CH3 - |
| Валин | Val (Вал) | (CH3)2CH - |
| Лейцин | Leu (Лей) | (CH3)2CH – CH2 - |
| Серин | Ser (Сер) | OH- CH2 - |
| Тирозин | Tyr (Тир) | HO – C6H4 – CH2 - |
| Аспарагиновая кислота | Asp (Асп) | HOOC – CH2 - |
| Глутаминовая кислота | Glu (Глу) | HOOC – CH2 – CH2 - |
| Цистеин | Cys (Цис) | HS – CH2 - |
| Аспарагин | Asn (Асн) | O = C – CH2 – │ NH2 |
| Лизин | Lys (Лиз) | NH2 – CH2- CH2 – CH2 - |
| Фенилаланин | Phen (Фен) | C6H5 – CH2 - |
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино-, три группы NH2 – триамино- и т.д.
Пример:

Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота:

ИЗОМЕРИЯ
1. Изомерия углеродного скелета

2. Изомерия положения функциональных групп

3. Оптическая изомерия

α-аминокислоты, кроме глицина NН2-CH2-COOH.
ФИЗИЧЕСКИЕ СВОЙСТВА
Аминокислоты представляют собой кристаллические вещества с высокими (выше 250°С) температурами плавления, которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны. Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в воде и нерастворимы в органических растворителях, чем они похожи на неорганические соединения. Многие аминокислоты обладают сладким вкусом.
ПОЛУЧЕНИЕ

3. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α - аминокислоты белков.
ХИМИЧЕСКИЕ СВОЙСТВА
Аминокислоты амфотерные органические соединения, для них характерны кислотно-основные свойства.
Видео-опыт «Свойства аминоуксусной кислоты»
I. Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
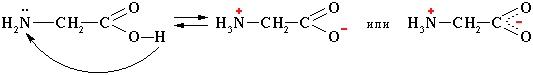
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
2. Поликонденсация → образуются полипептиды (белки):
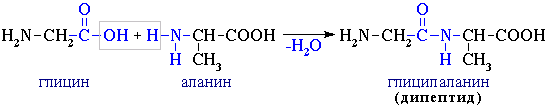
При взаимодействии двух α-аминокислот образуется дипептид.
3. Разложение → Амин + Углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COO H + Na OH → NH2-CH2-COONa + H2O
NH2-CH2-COONa - натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации): NH2-CH2-CO OH + CH3O H HCl(газ) → NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 - метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-CO OH + H -NH2 → NH2-CH(R)-CONH2 + H2O
4. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона):
