Структурная формула
Н - С ≡ С - Н
или
электронная формула
Н:С:::С:Н
По названию первого представителя этого ряда - ацетилена - эти непредельные углеводороды называют ацетиленовыми.
В алкинах атомы углерода находятся в третьем валентном состоянии (sp-гибридизация). В этом случае между углеродными атомами возникает тройная связь, состоящая из одной σ - и двух π -связей. Длина тройной связи равна 0,12 нм, а энергия ее образования составляет 830 кДж/моль.
Простейшим алкином является этин (ацетилен С2Н2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH-C- называется «этинил».
Этин:C2H2
Пропин: C3H4
Бутин: C4H6
Пентин: C5H8
Гексин: C6H10
Гептин: C7H12
Октин: C8H14
Нонин: C9H16
Децин: C10H18
Изомерия алкиновых углеводородов (как и алкеновых) определяется строением цепи и положением в ней кратной (тройной) связи:
(такая же как у алканов и алкенов)
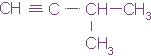 З-метилбутин-1
З-метилбутин-1
Н - С ≡ С - СН2 - СН2 - СН3 пентин-1
Н3С - С ≡ С - СН2 - СН3 пентин-2
Алкины являются изомерами с алкадиенами.
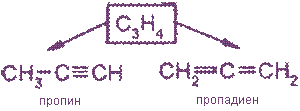
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) - газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше - в органических растворителях.
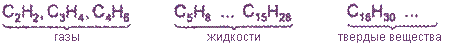
Плохо растворимы в воде.
Химические свойства алкинов определяются тройной связью, особенностями ее строения. Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления.
Будучи непредельными соединениями, алкины вступают в первую очередь в реакции присоединения. Эти реакции протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, - в одинарную.
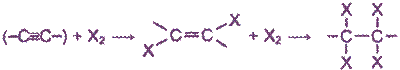
Казалось бы, алкины, обладая двумя π-связями, гораздо активнее должны вступать в реакции электрофильного присоединения. Но это не совсем так. Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах, и обладают большей электроотрицательностью. Это связано с тем, что электроотрицательность атома углерода зависит от его валентного состояния. Поэтому p-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Кроме того, сказывается, близость положительно заряженных ядер атомов, способных отталкивать приближающиеся электрофильные реагенты (катионы). В то же время алкины могут вступать в реакции нуклеофильиого присоединения (со спиртами, аммиаком и др.).
Реакция протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов вначале образуются алкены, а затем - алканы:
HC ≡ CH + H2 → H2C = CH2 + H2 → H3C—CH3
ацетилен → этилен → этан
Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
HC ≡ CH + Br2 → CHBr = CHBr + Br2 → CHBr2 - CHBr2
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Качественная реакция; бромная вода обесцвечивается.
Реакции присоединения галогеноводородов, как и галогенов, идут в основном по механизму электрофильного присоединения:
HC ≡ CH + HCl → H2C = CHCl → H3C - CHCl2
ацетилен → хлорэтен → 1,1-дихлорэтан
Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
Водородные атомы в ацетилене способны замещаться на металлы (реакция металлирования). В результате образуются металлические производные ацетилена - ацетилениды. Такую способность ацетилена можно объяснить следующим образом. Углеродные атомы ацетилена, находясь в состоянии sp-гибридизации, отличаются, как известно, повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях). Поэтому электронная плотность связи С-H несколько смещена в сторону углерода и атом водорода приобретает некоторую подвижность:
d+ d- d- d+
H→C≡C←H
Образуются нерастворимые соли - ацетилениды. Возможны только для алкинов, содержащих этинильную группу -С=СН (т. н. терминальные алкины).
HC ≡ CH + 2CuCl → Cu - C ≡ C - Cu↓ + HCl
этин → ацетиленид меди(I) двузамещенный
CH3 - C ≡ CH + CuCl → CH3 - C ≡ C- Cu↓ + HCl
пропин → метилацетиленид меди (I)