Тема. АЛКИНЫ.
(https://www.youtube.com/watch?v=ow7mjjUx7Z4)
1Ацетилен.
Загадка: Горит с образованием воды и углекислого газа, но не алкан; обесцвечивает бромную воду, но не алкен; подчиняется общей формуле С n Н 2n-2, но не алкадиен. Подсказка – содержит два атома углерода.
1.Частицы этого вещества есть на Уране и Нептуне.
2. Температура кипения этого вещества: - 84 °C.
3. При нормальных условиях - бесцветный газ, мало растворим в воде, легче воздуха.
4. Взрывоопасный газ.
5. Хранят в баллонах, заполненных активированным углем, пропитанным ацетоном.
6. В 1890г. в Ганновере некий злоумышленник забрался в банк, разрезал стенку сейфа этим веществом и скрылся с большой суммой денег. Прибывшие на место преступления эксперты пришли в замешательство: ни одним из известных им инструментов не возможно было так ровно разрезать сантиметровую сталь.
7. Применяется для резки и сварки металлов.
8. Молекулярная формула - С2Н2.
Ответ:
- горит с образованием воды и углекислого газа – УГЛЕВОДОРОД
- обесцвечивает бромную воду -- НЕПРЕДЕЛЬНЫЙ
- подчиняется общей формуле CnH2n-2 и содержит два атома углерода
Ответ: СН ≡ СН или С2Н2 - ацетилен.
Название этому веществу дал в 1860 году французский химик Марселен Бертло.
Алкины – это углеводороды, содержащие в своей структуре тройную связь. Общая формула ацетиленовых углеводородов СnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Н - С = С – Н ацетилен
Общая формула алкинов CnH2n-2
Составим гомологический ряд алкинов
| С2Н2 | |
| С3Н4 | |
| С4Н6 | |
| С5Н8 | |
| С6Н10 | |
| С7Н12 | |
| С8Н14 | |
| С9Н16 | |
| С10Н18 |
Строение алкинов.
Чтобы понять строение молекулы ацетилена, схематически покажем, как она образуется из двух молекул метана:
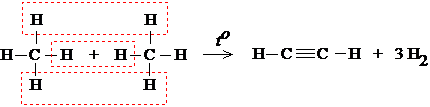
 Как видите, два атома углерода в молекуле ацетилена связаны тремя химическими связями. Иначе говорят, что между атомами углерода имеется тройная связь.
Как видите, два атома углерода в молекуле ацетилена связаны тремя химическими связями. Иначе говорят, что между атомами углерода имеется тройная связь.
Номенклатура. По рациональной номенклатуре производные ацетилена рассматриваются как его замещенные, называются радикалы с прибавлением слова «ацетилен».

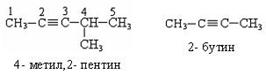 По систематической номенклатуре названия ацетиленовых углеводородов даются от соответствующих предельных углеводородов с заменой окончания на «-ин», нумерацию начинают с того конца, где ближе тройная связь:
По систематической номенклатуре названия ацетиленовых углеводородов даются от соответствующих предельных углеводородов с заменой окончания на «-ин», нумерацию начинают с того конца, где ближе тройная связь:
Формулы углеводороов ряда ацетилена можно вывести из формул предельных углеводородов.Их названия образуются путем замены суффикса -ан на суффикс -ин (этин, пропин, бутин и т.д.)
Правила составления названий алкинов по международной номенклатуре аналогичны правилам составления алкенов.
1. При составлении названия алкина выбирается самая длинная цепь, включающая тройную связь. Нумерация цепи идет с того конца, к которому ближе находится кратная связь, ее местоположение указывается наименьшим из двух номеров углеродных атомов.
Если тройная связь находится на одинаковом расстоянии от концов цепи, нумерацию ведут с того конца, к которому ближе находится заместитель.
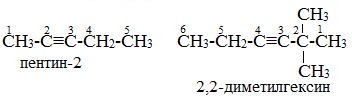
2. В названии соответствующего алкана окончание – ан заменяют на –ин.
2. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя.
3. Цифра, обозначающая положение тройной связи, ставится после суффикса –ин.
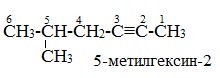
В номенклатуре различных классов органических соединений наиболее часто используется радикал, образованный от ацетилена (НС≡С─) – этинил.
Образование названий алкинов по номенклатуре ИЮПАК
Для первого члена гомологического ряда применяется исторически сложившееся название – ацетилен (этин).
Низшие члены гомологического ряда, имеющие простое строение, часто называют как производные ацетилена, у которого один или оба атома водорода замещены на алкильные группы.
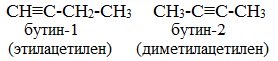
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C2H2
Структурная формула ацетилена H–C≡C–H
Электронная формула H: С ::: С: Н
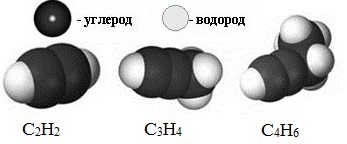
Простейшие представители:

Модели молекул
Получение. (https://www.youtube.com/watch?v=YcjPieRycxk) В лаборатории ацетилен получают при взаимодействии карбида кальция с водой: СаС2 + 2Н2О = С2Н2 + Са(ОН)2
В промышленности более 50% ацетилена получают из природного газа (крекинг метана при температуре 1500 0C)
2 СH4 = C2H2 + 3 H2↑
В этом процессе одним из промежуточных продуктов является ацетилен, но он тут же разлагается на углерод и водород:
C2H2→ 2C + H2↑
Если образующийся ацетилен быстро удалить из зоны реакции и охладить, можно предотвратить его разложение. Разработаны также методы выделения ацетилена из продуктов пиролиза нефти.
Межклассовая изомерия с алкадиенами.
- Изомерия положения тройной связи (начиная с С4Н6):

- 2. Изомерия углеродного скелета (начиная с С5Н8):
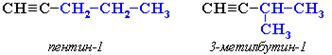
- Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:

Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом - вдоль линии связи.
3. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация.
(https://www.youtube.com/watch?v=pNEq3r3jrsA)
А) РЕАКЦИЯ ГАЛОГЕНИРОВАНИЯ
Происходит в две стадии по месту расположения пи- связи (сначала разрушается одна пи-связь, образуется алкен, затем вторая – образуется алкан).
1. Галогенирование (присоединение галогенов):
1 стадия. СН ≡ СН + Br2 (р-р) → СНВr = СНВr;
1,2-дибромэт ен
2 стадия. СНВr = CHBr + Br2 (р-р) → СНВr2— CHBr2
1,1,2,2-тетрабромэт ан
Суммарное уравнение: CH ≡CH + 2Br₂→CHBr₂—CHBr₂
Качественная реакция на пи-связь обесцвечивание бромной воды.
б) РЕАКЦИЯ ГИДРИРОВАНИЯ
СН = СН + Н2 ®. СН2 = СН2
Присоединение водорода:
СН ≡ СН + Н2 → Y
1 стадия: СН ≡ СН + Н2 → X;
2 стадия: X + H₂ → Y.
в) РЕАКЦИЯ ГИДРОГАЛОГЕНИРОВАНИЯ
СН ≡ СН + НСl → X
СН ≡ СН + НСl → СН2= СНСl винилхлорид
Продукт первой стадии винилхлорид используется в промышленности для реакций полимеризации получают полимер-поливинилхлорид (ПВХ) имеет важное промышленное значение.
г) ГИДРАТАЦИЯ
Реакция присоединения воды в присутствии солей ртути – реакция Кучерова:
СН ≡ СН + НОН → СН3—С = О ацетальдегид
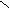 H
H
! Остальные алкины образуют кетоны
д) ОКИСЛЕНИЕ
1. Горение (закончить уравнение реакции):
С2Н2 + О2 →?
Ацетилен горит коптящим пламенем, т.к. соотношение атомов углерода и водорода в соединении одинаково.
2.*Обесцвечивание раствора перманганата калия КМnО4 качественная реакция на пи-связь:
СН ≡ СН + КМnО4 → СООН—СООН
щавелевая кислота
е) РЕАКЦИИ ПОЛИМЕРИЗАЦИИ
Реакции полимеризации
1.*Димеризация:
СН ≡ СН + СН ≡ СН → СН≡ С—СН=СН2 (CuCl)
бутен-1-ин-3 (винилацетилен)
2. Тримеризация:
СН ≡ СН + СН ≡ СН + СН ≡ СН → С6Н6
Бензол
(t=6000С, катализатор уголь активированный Сакт)