Самостоятельная работа №4. Растворы.
Для выполнения самостоятельной работы по этой теме следует предварительно изучить соответствующие главы учебника [1] (глава 8), теоретический лекционный материал и примеры решения задач и упражнений в [3], [6], [11]. Студенты должны знать классификацию сложных химических веществ: кислоты, основания, соли; понятия растворы, водные растворы, растворы электролитов; теорию диссоциации; уметь идентифицировать сильные и слабые электролиты. Рассчитывать соответствующие параметры, характеризующие свойства водных растворов: степень диссоциации, константа диссоциации, ионная сила раствора, ионное произведение воды, водородный показатель раствора, гидролиз солей, малорастворимые электролиты, произведение растворимости, растворимость.
Самостоятельная работа №4 содержит 5 расчетных заданий по характеристикам и свойствам водных растворов электролитов, имеющих наиболее важное значение в технологических процессах. Данные для выполнения всех заданий для 32 вариантов приведены в таблице. Рассмотрим для примера один из вариантов.
Таблица. Исходные данные n-варианта.
| V,л | Вещество | Т1,Т2 | Вещество | |||||
| A a,г | B b,г | С с,г | D d,г | E+F | G | H | ||
| 0,4 | KNO2 1,360 | KOH 0,672 | HNO2 0,752 | 299,345 | Sc2(SeO4)3 2,076 | AgNO3 NaNO2 | Cu(OH)2 | Na6[Cu(P2O7)2] |
Задание 1.
Имеется водный раствор объёмом V,л, содержащий а, г, вещества А и b, г вещества В.
Это задание для проверки навыков и умений по составлению уравнений диссоциации для сильных электролитов, расчета ионной силы и водородного показателя рН в растворах сильных электролитов, умения пересчитывать концентрацию раствора, заданную в одной из единиц измерения концентраций, в любую другую.
1.1. К каким электролитам можно отнести растворы этих соединений? Напишите уравнения реакций диссоциации этих электролитов.
Ответ:
(вещество А) KNO2 → K+ + NO2- – все соли сильные электролиты
(вещество В) KOH→ K+ + OH- – растворимое основание (щелочь) сильный электролит;
Сильные электролиты в растворах диссоциируют необратимо (в записях необратимость процесса обозначается одной стрелкой вправо).
1.2. Рассчитайте ионную силу раствора п. 1.1. Как изменится ионная сила, если к раствору добавить 0,5 л Н2О?
Ответ:
I=  ∑cizi2, где ci – молярные концентрации отдельных ионов (моль/л),а zi – заряды ионов
∑cizi2, где ci – молярные концентрации отдельных ионов (моль/л),а zi – заряды ионов
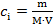 ;
;
где m – масса растворенного вещества, М – молярная масса вещества, V - объем раствора.
M(KNO2) = 39г/моль + 14г/моль + 2∙16г/моль = 85 г/моль
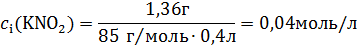
M (KOH) = 39 г/моль + 16 г/моль + 1 г/моль = 56 г/моль

I1 =  (
(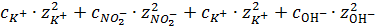 ) =
) =  (0,04∙1+0,04∙1+0,03∙1+0,03∙1) = 0,07
(0,04∙1+0,04∙1+0,03∙1+0,03∙1) = 0,07
При добавлении 0,5 л Н2О увеличивается объём раствора, поэтому уменьшается молярная концентрация ионов, следовательно, ионная сила раствора уменьшится.
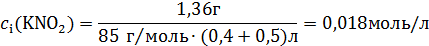

I1 =  (
(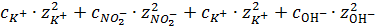 ) =
) =  (0,018∙1+0,018∙1+0,013∙1+0,013∙1) = 0,031
(0,018∙1+0,018∙1+0,013∙1+0,013∙1) = 0,031
1.3. Определите водородный показатель раствора при 25°С.
Ответ:
Для щелочных растворов водородный показатель рН определяется из соотношения р КW = pH + pOH, где р КW = -lg КW = 14 (КW – ионное произведение воды, равное при 298К КW = 10-14):
pH=14 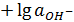 , где
, где  (
(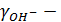 коэффициент активности гидроксид ионов, определяемый либо по приближенным формулам, либо по правилу ионной силы, согласно которому коэффициенты активности ионов одинакового заряда в растворах с одинаковой ионной силой равны по величине (см. таблицу):
коэффициент активности гидроксид ионов, определяемый либо по приближенным формулам, либо по правилу ионной силы, согласно которому коэффициенты активности ионов одинакового заряда в растворах с одинаковой ионной силой равны по величине (см. таблицу):
| Ионы | Коэффициент активности  для ионной силы для ионной силы
| |||||
| 0,001 | 0,01 | 0,02 | 0,05 | 0,07 | 0,1 | |
| водорода Однозарядные Двухзарядные Трёхзарядные | 0,98 0,98 0,77 0,73 | 0,92 0,92 0,58 0,47 | 0.90 0,89 0,50 0,37 | 0,88 0,85 0,50 0,37 | 0,86 0,83 0,36 0,25 | 0,84 0,80 0,30 0,21 |
=> для КОН: рН = 
рН =  (рН > 7 – среда щелочная)
(рН > 7 – среда щелочная)
1.4. Для раствора объёмом V, л, содержащего b, г вещества В, рассчитайте:
а) молярную концентрацию См, моль/л;

M (KOH) = 39 г/моль + 16 г/моль + 1 г/моль = 56 г/моль

б) массовую долю вещества ω (%) ρ=1;

 = 0,00168%
= 0,00168%
в) молярную концентрацию эквивалента сН моль/л;
 , где
, где 
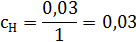
г) титр раствора Т, г/мл.


Задание 2.