В этом задании проверяются навыки и умения по составлению уравнений гидролиза для растворов солей, расчета степени гидролиза и водородного показателя рН в растворах гидролизующихся солей.
3.1. Какие процессы имеют место в растворе? Напишите уравнения реакций этих процессов.
Ответ:
В данном растворе имеют место процессы диссоциации и гидролиза.
1) Sc2(SeO4)3 – это соль, все соли сильные электролиты.
Реакция диссоциации: Sc2(SeO4)3 → 2Sc3+ + 3 SeO42-
2) Sc2(SeO4)3 –это соль, образованная сильной кислотой (H2SeO4) и слабым основанием (Sc(OH)3), поэтому в растворе подвергается гидролизу – реакции обмена с водой слабой части соли с образованием слабого электролита. Ион скандия многозарядный, поэтому гидролизуется ступенчато:
1 ст.: Sc3+ + HOH Û (ScOH)2+ + H+
2 ст.: ScOH2+ + HOH Û Sc(OH)2+ + H+
3 ст.: ScOH+ + HOH Û Sc(OH)3
3.2. Рассчитайте водородный показатель раствора при 25°С и стандартных состояниях, учитывая только одну ступень процесса.
Ответ:
В результате гидролиза соли по катиону в растворе появляется избыток иона водорода, среда становится кислой. Расчёт pH гидролиза по катиону (Кд (Sc(OH)3) =7,6∙10-10 - 3ст.):
pH = 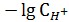

где β  – степень гидролиза, равная отношению равновесной концентрации гидролизованных ионов к исходной концентрации ионов соли, подвергающихся гидролизу. Степень гидролиза связана с константой гидролиза и исходной концентрацией соотношением, аналогичным закону Оствальда:
– степень гидролиза, равная отношению равновесной концентрации гидролизованных ионов к исходной концентрации ионов соли, подвергающихся гидролизу. Степень гидролиза связана с константой гидролиза и исходной концентрацией соотношением, аналогичным закону Оствальда:

В выражение для константы гидролиза по I ступени подставляем табличное значение константы диссоциации Sc(OH)3 по последней ступени:


M(Sc(OH)3) = 45г/моль + 3∙16г/моль + 3∙1г/моль = 96г/моль

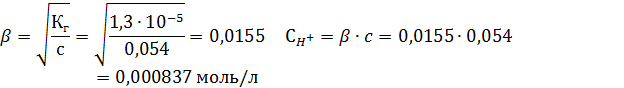
pH=  (pH<7 – среда кислая)
(pH<7 – среда кислая)
3.3. Объясните смещение равновесия в растворе при:
а) добавлении раствора вещества В;
Ответ:
при добавлении КОН в растворе появляется избыток гидроксид-ионов ОН-. Согласно принципу Ле Шателье равновесие сместится вправо. Гидроксид ионы ОН- связывают из раствора ионы H+ с образованием слабого электролита – воды, концентрация ионов Н+ уменьшится, а
pH увеличится.
б) добавлении 0,5 л Н2О;
Ответ:


pH=  . При добавлении воды уменьшается концентрация соли, степень гидролиза увеличивается.
. При добавлении воды уменьшается концентрация соли, степень гидролиза увеличивается.
в) увеличении температуры;
Ответ:
Реакция гидролиза – эндотермическая реакция. По принципу Ле Шателье при увеличении Т равновесие реакции смещается в сторону эндотермических реакций => в сторону гидролиза (равновесие сместится вправо), то есть концентрация ионов водорода увеличится, а pH раствора соответственно уменьшится
Задание 4.
В этом задании проверка знаний и умений по расчетам в растворах мало растворимых веществ: произведения активностей, возможность выпадения осадка, растворимость малорастворимых веществ.
Имеется два раствора:
а) 5мл 0,004М раствора вещества Е (AgNO3);
б)15мл 0,003М раствора вещества F (NaNO2);
4.1. Определите, произойдет ли выпадение осадка при сливании этих растворов?
Ответ:
При сливании 15 мл одного раствора и 5 мл второго общий объем системы станет 20 мл. Рассчитаем концентрации солей в объеме 20 мл.
а) AgNO3→Ag++NO3-
 0,004моль/л – 20мл
0,004моль/л – 20мл
=> х=  = 10-3 моль/л
= 10-3 моль/л
х моль/л – 5мл
б) NaNO2→Na++NO2-
 0,003моль – 20мл
0,003моль – 20мл
=> х=15∙0,003:20 = 2,25∙10-3 моль/л
х моль – 15мл
При слиянии растворов образуется малорастворимая соль нитрит серебра:
Ag++ NO2-→ AgNO2↓
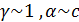

ПР(табличное) = 3,1∙10-10
Если произведение активностей (ПА) ионов в растворе больше табличного значения произведения растворимости (ПР), то выпадает осадок труднорастворимого соединения.
 => осадок выпадает
=> осадок выпадает
4.2. Рассчитайте величину растворимости осадка (п.4.1.) в чистой воде. Как изменится растворимость, если растворителем будет раствор вещества А (см. задание 1).
Ответ:
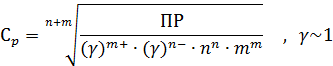


Если растворителем будет KNO2:
Концентрация каждого иона в насыщенном растворе электролита может быть изменена, но при этом изменяется и концентрация другого иона так, что произведение концентраций сохраняет прежнюю величину. Поэтому, если в насыщенный раствор электролита ввести некоторое количество одного из ионов, входящих в состав электролита, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть растворимость электролита понижается от введения в раствор одноименных ионов.
4.3. Определите значение водородного показателя, при котором начинается выпадение осадка вещества G (Cu(OH)2) при 25°С и стандартных состояниях?
Ответ:
1ст.: Cu(OH)2↔ CuОН ++ОН-
2ст.: CuОН +↔ Cu2++ОН- (слабый электролит, 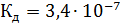 )
)
pH=14 
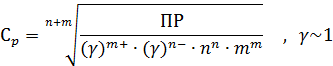



pH=14 
Выпадение осадка начнется при рН=11.
Задание 5.
В этом задании рассматриваются растворы комплексных соединений. Следует знать понятие константы нестойкости комплексов (табличные значения); уметь писать реакции диссоциации комплексных соединений.