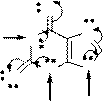
Гидроксипроизводные пурина – гипоксантин, ксантин и мочевая кислота – являются продуктами метаболизма азотистых оснований нуклеиновых кислот и свободных нуклеотидов в организме. Гипоксантин (6- гидроксипурин), ксантин (2,6-дигидроксипурин) и мочевая кислота (2,6,8- тригидроксипурин) – таутомерные соединения. Для них характерны лактим- лактамная и прототропная таутомерия. В твердом состоянии и в организме при физиологических значениях рН все эти соединения имеют лактамную форму.
Таутомерия гидроксипроизводных пурина:

O  H
H


 N N лактим-
N N лактим-

 O
O
H N N

 прото-
прото-
O H



 H N N
H N N
 N N H
N N H
гипоксантин
лактамная
N N тропная N NH

 O H
O H


 N N лактим-
N N лактим-

 O
O
H N N
 прото-
прото-
O H

 H N N
H N N


 H O N N
H O N N
лактамная
O N N
тропная
O N N

H
 H H H
H H H
ксантин


 O H
O H
 N N
N N
 O H
O H

O H
 лактим- H N N
лактим- H N N
 O
O

 H O N N
H O N N

лактамная
O N N
H H H
мочевая
кислота
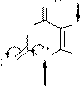
Кислотные свойства мочевой кислоты.
Мочевая кислота имеет свойства двухосновной слабой кислоты (рКа1 5,7; рКа2 ~ 10) и образует два ряда солей – кислые и средние. Соли мочевой кислоты называются ураты. Кислые ураты малорастворимы в воде и образуют осадки, которые растворяются в избытке щелочи (NaOH, KOH). Средние ураты натрия, калия растворяются в воде. Средний урат аммония малорастворим.
Схемы реакций образования уратов:
 O H O
O H O


 H N N H N
H N N H N
H O H




 N NaOH H N N
N NaOH H N N


 O O O
O O O
 O N N
O N N
HO N N
-H2O
NaO N N

 более
более
 H H сильный H H
H H сильный H H
мочевая кислота
кислотный центр
кислый урат натрия (малорастворим)
 O
O
 H N
H N

H O




|

-H O
H

 N ONa
N ONa
O H



 2NH4Cl H N N
2NH4Cl H N N

-2NaCl
ONH4
 NaO N N
NaO N N
H
2 NaO N N
H4NO N N
 H
H
средний урат натрия (растворим в воде)
средний урат аммония (малорастворим в воде)
Реакции с нуклеофильными реагентами.
Гидроксипроизводные пурина превращаются в галогенопроизводные в результате реакции нуклеофильного замещения с оксохлоридом фосфора(V).
Пример реакции нуклеофильного замещения у гидроксипроизводных пурина:

 O H
O H

 H N +dN
H N +dN
O
OH Cl


|
|

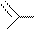 избыток
избыток

 OH -H PO Cl
OH -H PO Cl

 O N N
O N N
HO N
3 4 Cl N
 H H H
H H H
мочевая кислота
H
2,6,8-трихлорпурин
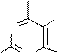
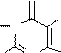
На основе трихлорпурина могут быть получены другие производные пурина (реакцией нуклеофильного замещения), а также сам пурин (реакцией восстановления). Атомы хлора в положениях 2,6,8 пуринового цикла различаются способностью к замещению. Их подвижность, обычно, соответствует ряду: С6>C2>C8. Поэтому при использовании на разных стадиях замещения различных нуклеофильных реагентов могут быть синтезированы смешанные производные пурина.
Примеры реакций S N и восстановления галогенопроизводных пурина:
 Cl
Cl
 N +d N
N +d N
OH

 KOH, t o N N
KOH, t o N N

OH


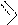
 2NH N N
2NH N N

 Cl +d
Cl +d
Cl 3 Cl

 Cl N NH
Cl N NH
-KCl Cl N N OH H
-NH4Cl
 O
O
H2N N N H
 2HI
2HI
восстановление
-I2, -HCl
N N


 H2N N N H
H2N N N H
2-амино-6-гидроксипурин (гуанин)
H N N

 H2N N N H
H2N N N H
Мурексидная реакция.
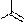
Мурексидная реакция применяется для определения ксантинов и мочевой кислоты. Реакция основана на окислении этих соединений концентрированной азотной кислотой или пероксидом водорода в кислой среде. Разрушению при окислении подвергается пятичленный цикл молекул, одним из промежуточных продуктов являются аллоксан (5-оксобарбитуровая кислота) или его производные. Затем происходит конденсация аллоксана с другими промежуточными продуктами реакции. В результате образуется пурпурная кислота, которая с аммиаком или щелочью (КОН) дает цветные соли мурексиды. Мурексид аммония окрашен в пурпурно-красный цвет, мурексид калия – в сине-фиолетовый.
Схема мурексидной реакции:

 O H
O H
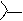 H N +d N
H N +d N
HNO 3конц
O O



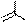

 H N O H N H
H N O H N H



O to
+d + O H

 O N N -?
O N N -?
O N O

O N O

H H
 O OH
O OH
H H
 аллоксан
аллоксан


 O
O
H


 H N +d O
H N +d O
 O N O OH
O N O OH
N H NH3 H N N




 -H2O
-H2O

 N O O N O O
N O O N O O
H H
N H NH3,H2O



 N O H
N O H

 O ONH4
O ONH4
пурпурная кислота



 H N N N H
H N N N H

 O N O O N O H H
O N O O N O H H
мурексид аммония (красно-пурпурный)
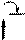
Синтез кофеина из мочевой кислоты:
 +d O
+d O


 O H
O H
H N +d N
O

 O N N
O N N
H3C C




 O H3C C O
O H3C C O
-CO2
O H




 H N N
H N N
 O N N
O N N

O




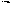 C CH3 O
C CH3 O
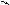 C CH
C CH
H H
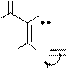

 O H O
O H O
H 3

 H O H
H O H
H3C O



N C CH N

SO2
 H C O
H C O



 H N
H N
 O N NH
O N NH
 OH
OH
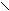 C
C
+d CH3
H N
 -CH3COOH
-CH3COOH
 O N
O N
H


 C CH3
C CH3
N

NaOH
 H3C
H3C
O
1) HOH
O

 N
N
 N CH3
N CH3
CH3 N


 C
C
N
CH3
Cl2





 CH3
CH3
H3C
O
O


 N
N
 N CH3
N CH3
CH3 N



 C
C
N
CCl3
 гидролиз
гидролиз
2) -CO2
H3C
O
N N
 N N
N N
CH3
Понятие об алкалоидах.
"Alkali" – щелочь, то есть основание. Алкалоидами называют природные (главным образом растительного происхождения) азотсодержащие органические основания. В настоящее время известно несколько тысяч алкалоидов.
В природе алкалоиды содержатся в составе растений в виде солей с органическими кислотами, такими как лимонная, яблочная и другими. Содержание алкалоидов в растениях колеблется в широких пределах от 0,001 до 18%. Многие соли алкалоидов водорастворимы, сами алкалоиды растворяются в органических растворителях (например, в СНCl3, бензоле). Поэтому для получения алкалоидов растительное сырье, обычно, обрабатывают щелочью для перевода алкалоида из соли в молекулярную форму и затем экстрагируют алкалоид в подходящий органический растворитель. Для разделения и очистки алкалоидов применяют как традиционные методы органической химии, например, перекристаллизацию, так и современные физико-химические методы такие как хроматография. Для идентификации алкалоидов применяют главным образом масс- спектрометрию и спектральные методы (ИК-, УФ-, ЯМР- и другие виды спектроскопии).
Все алкалоиды – физиологически активные соединения. Некоторые из них сильные яды, но многие алкалоиды в определенных дозах давно используются медициной.
Большинство алкалоидов являются гетероциклическими соединениями. Классифицируют алкалоиды по нескольким признакам, но наиболее удобной признана их классификация на основе строения азотно- углеродного скелета соединения. Например, известны пуриновые алкалоиды, алкалоиды группы пиридина, группы хинолина и другие.
Реакции каждой группы алкалоидов достаточно сложны и разнообразны. Но все алкалоиды образуют соли с кислотами, потому что все алкалоиды – основания. Реакции образования малорастворимых в воде солей могут быть использованы как общие качественные реакции на алкалоиды. Например, реакции с пикриновой кислотой, с таннином и другие.
Примеры качественных общеалкалоидных реакций:
алкалоид +
пикриновая кислота
желтый осадок
 телесный осадок коричневый осадок
телесный осадок коричневый осадок
Известны специфические реакции, характерные только для отдельных алкалоидов или групп алкалоидов. Эти сложные реакции обусловлены особенностями состава и строения соединений. Например, мурексидная проба на пуриновые алкалоиды, таллейохинная проба на хинин.
Для каждого алкалоида можно прогнозировать некоторые реакции, типичные для тех функциональных групп и структурных фрагментов, которые входят в его состав. Например, для атропина должны быть характерны реакции сложных эфиров, для морфина – реакции фенолов.
Примеры алкалоидов.

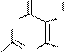
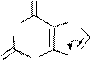
 Пуриновые алкалоиды – теофиллин (1,3-диметилксантин), теобромин (3,7-диметилксантин), кофеин (1,3,7-триметилксантин) являются метилированными по азоту производными ксантина.
Пуриновые алкалоиды – теофиллин (1,3-диметилксантин), теобромин (3,7-диметилксантин), кофеин (1,3,7-триметилксантин) являются метилированными по азоту производными ксантина.

 O H
O H
 H3C
H3C
N N
H O CH3N N
O
 H3C
H3C


 N
N
CH3 N


 O N N CH3
O N N CH3
O N N CH3
O N N CH3
 теофиллин теобромин кофеин
теофиллин теобромин кофеин
Теофиллин и теобромин амфотерные соединения, они образуют соли как с кислотами, так и с основаниями. Для них характерны таутомерные превращения. В свободном состоянии они существуют в лактамной форме. Кофеин является только основанием, таутомерия для него невозможна.
Таутомерия теофиллина и теобромина:

 O
O
 H3C
H3C
N
H O H
N 


|


 O N N CH3
O N N CH3

 теофиллин
теофиллин
O N N CH3

 H O CH3
H O CH3

|


O H CH3N N


 O N N CH3
O N N CH3
O
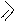 теобромин
теобромин
N N
 CH3
CH3
Примеры реакций образования солей:
 O CH3
O CH3
O CH3





 H N N
H N N
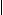 O N N Cl
O N N Cl


 H N N
H N N

 O N N
O N N
O2N
OH
 NO2
NO2
CH3 H
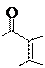
|


 NO H N
NO H N
CH3 N



 O2N
O2N
NO2

 2
2

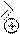

 O N N
O N N
кислотный
CH3 H
NO2
центр
пикрат теобромина (желтый

 O H
O H

N N
 O N N
O N N
CH3 NaOH
-H2O
ONa


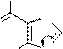 N
N
 O N
O N
CH3
 N
N
N

осадок)
H3C
O
CH3
 O
O

 N
N

 N CH3
N CH3
CH3 N


 N
N
COOH
HO  OH OH
OH OH

CH3
 H3C
H3C
O
O


 N
N
 N CH3
N CH3
CH3 N


 N H
N H
COO


 HO OH
HO OH
OH
 Теофиллин и теобромин в щелочной среде с катионом Со(II) образуют цветные соли: серо-голубую кобальтовую соль теофиллина и розовую кобальтовую соль теобромина.
Теофиллин и теобромин в щелочной среде с катионом Со(II) образуют цветные соли: серо-голубую кобальтовую соль теофиллина и розовую кобальтовую соль теобромина.
Качественные реакции теофиллина и теобромина:
 O
O

 H3C N
H3C N
H OH


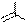


 N H3C N N
N H3C N N
 NaOH
NaOH
H3C
ONa



 N
N
N CoCl2

 O N N
O N N
CH3
теофиллин
O N N CH3




 O
O
-H2O
O N N CH3
-NaCl


 H3C O
H3C O
N
 N CH3
N CH3
N
Co2+
N
серо-голубой осадок




 O CH3
O CH3
 CH3
CH3

 CH3
CH3
 H N N
H N N
 O N N CH3
O N N CH3
N N


 O N
O N
CH3
NaOH
-H2O
N N
O 


 N
N
CH3
CoCl2

-NaCl
 теобромин
теобромин
 |


 N
N
 O N
O N
CH3
CH3 N


 N
N
Co2+ 2
розовый осадок
Положительную мурексидную пробу дают тефиллин, теобромин и кофеин. Пуриновые алкалоиды в мурексидной пробе окисляются пероксидом водорода в кислой среде. Схема мурексидной реакции аналогична записи пробы для мочевой кислоты.
Теобромин, теофиллин и кофеин применяются в медицине.
Алкалоиды группы пиридина.
 К этой группе алкалоидов относятся никотин и анабазин. Никотин – N- метил-2-(3-пиридил)пирролидин. В его молекуле связаны циклы пиридина и метилированного по азоту пирролидина. Анабазин – 2-(3-пиридил) пиперидин.
К этой группе алкалоидов относятся никотин и анабазин. Никотин – N- метил-2-(3-пиридил)пирролидин. В его молекуле связаны циклы пиридина и метилированного по азоту пирролидина. Анабазин – 2-(3-пиридил) пиперидин.
 *
*
N sp2
N sp3
CH3
sp3
никотин анабазин
Никотин и анабазин – оптически активные вещества. Они являются двухкислотными основаниями (образуют соли с одним и двумя
эквивалентами кислоты). В жестких условиях окисляются с образованием никотиновой кислоты.
Примеры реакций:
 N
N
N CH3
HCl

 N
N
COOH
HCl


 Cl
Cl
N
 N H3C HH
N H3C HH

 2Cl
2Cl
Никотин и анабазин токсичны, смертельная для человека доза никотина 30-60 мг.
Алкалоиды группы хинолина.
 Группу хинолина образуют алкалоиды хинного дерева. Хинин является одним из них. Молекула хинина состоит из замещенных циклов хинолина и хинуклидина, связанных через гидроксиметинную группу:
Группу хинолина образуют алкалоиды хинного дерева. Хинин является одним из них. Молекула хинина состоит из замещенных циклов хинолина и хинуклидина, связанных через гидроксиметинную группу:




 H
H
H3CO
Nsp2
хинин
ероцикл хинуклидина
Хинин оптически активен. Является двухкислотным основанием и образует соли с одним и двумя эквивалентами кислоты. Хинин дает общеалкалоидные реакции. Известна специфическая проба на хинин – таллейохинная проба.
Пример общеалкалоидной реакции (образование пикрата хинина):
H3CO
OH


 HC N
HC N
H
CH=CH2


 Cl
Cl
O2N
O H

 NO2
NO2
-HCl
N
хинина гидрохлорид (растворимая в воде соль хинина и соляной кислоты)


 OH
OH

 HC N
HC N
 H3CO H
H3CO H
N
NO2
пикриновая кислота
 CH=CH2
CH=CH2
 O2N
O2N
O
 NO2
NO2
 NO2
NO2
пикрат хинина (желтый осадок)

|
Схема таллейохинной реакции:
 CH=CH2
CH=CH2
OH
Br


 CH-CH2
CH-CH2
OH Br
HC
H3CO
N
NH, H O
Br2, H2O


 N Cl
N Cl
H

 CH-CH2
CH-CH2
O HC N O H

 N
N
3 2 OH

 NHHC
NHHC
HN
OH OH
N
N
таллейохин (изумрудно-зеленый раствор)
Хинин применяется в медицине.
Алкалоиды группы изохинолина и фенантренизохинолина.
Папаверин, морфин и кодеин – примеры алкалоидов этого ряда (алкалоиды опиума).
5 4
 H3CO 6 3
H3CO 6 3
7 N
 8
8
папаверин (6,7-диметокси-1- [3',4'-димето- ксибензил]изохинолин)