ТЕМА 8. Конденсированные гетероциклические соединения.
Алкалоиды.
ПЛАН.
1. Примеры конденсированных гетероциклических соединений.
2. Общие представления о реакционной способности пурина и его производных.
3. Гидроксипроизводные пурина.
4. Понятие об алкалоидах.
5. Примеры алкалоидов.
Примеры конденсированных гетероциклических соединений.
Среди природных конденсированных гетероциклических соединений особое медико-биологическое значение имеют производные пурина и птеридина. Гидрокси- и аминопроизводные пурина, как структурная часть, входят в состав нуклеиновых кислот, свободных нуклеотидов организма, коферментов. Наиболее биологически важные производные птеридина представлены двумя группами соединений: группой фолиевой кислоты (регуляторы белкового и углеводного обмена) и группой рибофлавина, например, коферментом ФАД (флавинадениндинуклеотид), который осуществляет окислительно-восстановительные биохимические процессы и является более сильным окислителем, чем соединения на основе катиона N- алкилпиридиния.
В молекуле пурина сконденсированы гетероциклы пиримидина и имидазола, в молекуле птеридина – гетероциклы пиримидина и пиразина:
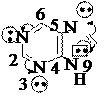 7
7
1 8
пурин
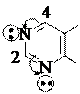
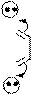 3 N 6
3 N 6
N 7
1 8
птеридин
Пурин и птеридин имеют ароматическое строение с энергией резонанса у пурина 243,6 кДж/моль и 259,5 кДж/моль у птеридина. Они изоэлектронны нафталину и имеют 10-электронную p-систему: 10= 4n+2, n=2. В молекуле пурина из четырех гетероатомов один атом азота имеет пиррольное (электронодонорное) строение и предоставляет пару электронов в состав единой p-электронной системы молекулы, неподеленные электронные пары остальных атомов азота "свободны" и занимают гибридные орбитали в плоскости структуры. В молекуле птеридина все четыре гетероатома имеют пиридиновое (электроноакцепторное) строение и их неподеленные пары в образовании p-системы молекулы не участвуют. В
целом электронная система птеридина проявляет себя как более электроноакцепторная структура, чем пуриновая.
Общие представления о реакционной способности пурина и его производных.
Строение пурина, его гидрокси- и аминопроизводных делает в общем случае возможными таутомерные превращения этих соединений, их реакции как с кислотами, так и с основаниями, реакции с нуклеофилами и электрофилами, а также реакции присоединения и замещения, протекающие по радикальному механизму. Направление в гетероцикле пурина тех или или иных реакций сильно зависит от природы и положения заместителей.
За кислотные свойства пурина отвечает протон на пиррольном атоме азота. Пурин слабая N-H кислота (рКа ~ 9) образует анионные соли с такими сильными основаниями, как амиды калия или натрия. За основные свойства пурина и его производных отвечает, главным образом, пиридиновый атом азота в имидазольном кольце. Пурин – амфотерное соединение.
Кислотные и основные свойства пурина:
 H
H
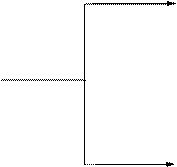
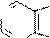
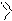
 HCl N N Cl
HCl N N Cl
более активный N N
основный центр H
 |
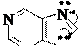
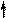 N N
N N
H+d
N-H-кислотный центр
pKa ~ 9
NaNH2 N Na

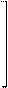

|
Для пурина характерна прототропная таутомерия с обратимым переносом протона из N-H-кислотного центра в более активный основный центр молекулы. Подвижная p-электронная система обеспечивает необходимое для этого перераспределение электронов. Таутомеры пурина называются 9Н-пурин и 7Н-пурин и имеют, примерно, одинаковую устойчивость.
Прототропная таутомерия пурина:
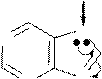 H
H
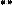 6 7
6 7
|

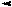 8
8
|
|
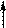
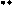 3 N
3 N
H
9H-пурин
7H-пурин
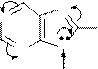
Реакции электрофильного замещения (SE) не имеют большого значения для пурина и его производных, потому что все атомы углерода в гетероцикле пурина являются электронодефицитными из-за акцепторного влияния соседних с ними пиридиновых атомов азота. Сам пурин в реакции SE не вступает. Производные пурина с электронодонорными заместителями дают продукты замещения по восьмому атому углерода.
Примеры реакций SE:
 N +d N
N +d N
H
SE
не вступает

+d N N +d


 H
H
p -недостаточная система
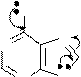 NH2
NH2
NH2
N N 8 H
 N N
N N
 H
H
Br2, CH3COOH
N N Br

 N N
N N
H
8-бромаденин
(6-амино-8-бромпурин)
 H3C O CH3
H3C O CH3
O CH3
 N N 8 HNO, to
N N 8 HNO, to
H3C N

H 3
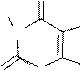
 O N NCH3
O N NCH3
N 8
 O N N CH3
O N N CH3
NO2
8-нитрокофеин
Реакции алкилирования и ацилирования происходят по атомам азота. У пурина алкилируются и ацилируются атомы азота в имидазольном цикле. В качестве субстратов алкилирования применяют алкилгалогениды, алкилсульфаты. Для ацилирования – ацилгалогениды и ангидриды:
 N N
N N
 N N
N N
H CH3--I, NaOH
 cубстрат
cубстрат

 H
H
 N N
N N
N N
 +
+
 N N CH3
N N CH3
CH3
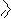
 N N
N N
N N
N N
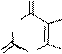
У производных пурина направление реакций алкилирования и ацилирования определяется природой и положением заместителей. В определенных условиях могут быть проалкилированы атомы азота как в имидазольном, так и пиримидиновом циклах:
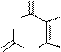
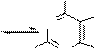 O OH
O OH
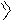 HN N N N
HN N N N
+d

 H3CO
H3CO
SO2
 H3C O
H3C O
 ,NaOH
,NaOH

 водный
водный
O
 H3C
H3C
N
CH3 N

 O N N H
O N N H
H
HO N N H
O N N CH3
Реакции нуклеофильного замещения (SN), участвуя в которых, гетероцикл выступает в качестве субстрата, являются важными для химии пурина и его производных. Их примеры будут рассмотрены на производных пурина.