Е. Вариант 1.
Часть 1
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) C 2) H 3) O 4) Mg 5) N
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов.
2. Из указанных в ряду элементов выберите три элемента, которые в системе химических элементов находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения восстановительной способности их атомов.
3. Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +4.
4. Из перечня выберите два вещества, которые имеют ионное строение:
1) кремний 2) красный фосфор 3) белый фосфор
4) сульфид калия 5) нитрид лития
5. Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит:
А) гидроксид хрома(III) 1) основания4) гидроксиды амфотерные
Б) гидроксид хрома(VI) 2) кислоты5) соли кислые
В) сульфат аммония3) соли средние6) соли смешанные
6. Из предложенного перечня выберите два вещества, которые образуются при растворении оксида хрома(VI) в избытке раствора гидроксида калия.
1) дихромат калия 2) хромат калия 3) гидроксид хрома(II)
4) гидроксид хрома(III)5) вода
7. Нитрат серебра прокалили. К образовавшемуся твёрдому остатку X добавили концентрированную азотную кислоту, при этом наблюдали интенсивное выделение газа Y. Из предложенного перечня выберите вещества X и Y.
1) оксид серебра(I) 2) нитрит серебра 3) серебро
4) оксид азота(II) 5) оксид азота(IV)
8. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать:
А) S 1) HCl, Al, CO
Б) Ca 2) H2O, Na2O, H2O2
В) SO2 3) P, H2O, HF
Г) Fe2O3 4) O2, Fe, H2
5) BaO, H2O, P2O5
9. Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ:
А) FeO и HNO3(конц.) 1) Fe(OH)3, NO2иH2O
Б) Fe3O4иHNO3(конц.) 2) Fe(OH)3 и H2O
В) Fe2O3 и HNO3(конц.)3) Fe(NO3)2 и H2O
Г) Fe(OH)2 и HNO3(конц.) 4) Fe(NO3)3и H2O
5) Fe(NO3)3, N2O5и H2O
6) Fe(NO3)3, NO2иH2O
10. Определите вещества X и Y в схеме превращений:



 PH3O2 X KOH K3PO4Ca(OH)2 Y H2SO4H3PO4
PH3O2 X KOH K3PO4Ca(OH)2 Y H2SO4H3PO4
1) ортофосфорная кислота 2) фосфористая кислота 3) фосфат кальция
4) гидрофосфат кальция 5) дигидрофосфат кальция
11. Установите соответствие между названием эфира и его формулой:
А) метилпропионат1) C3H7–O–C3H74) C2H5COOCH3
Б) метилэтиловый эфир 2) C2H5–O–CH35) C6H5COOC2H5
В) этиловый эфир бензойной кислоты 3) CH3COOC3H76) C6H5COOCH3
12. Из предложенного перечня выберите два вещества, которые являются гомологами пропановой кислоты.
1) этановая кислота 2) бензойная кислота 3) этилацетат
4) пентановая кислота 5) метилформиат
13. Из предложенного перечня выберите два вещества, которые образуются при электролизе раствора пропионата натрия.
1) бутан 2) пропан 3) этан 4) метан 5) водород
14. Из перечня выберите два вещества, которые не реагируют с хлороводородом:
1) уксусная кислота 2) фенол 3) пропеновая кислота
4) пропанол-1 5) пропанол-2
15. Из перечня выберите два вещества, которые реагируют с глицином:
1) этан 2) хлорид калия 3) гидроксид калия 4) азот 5) азотистая кислота
16. Установите соответствие между реагирующими веществами и продуктами их взаимодействия:
А) бензол и хлорметан (в присутствии катализатора) 1) толуол
Б) бензол и пропен (в присутствии катализатора) 2) пропилбензол
В) гексен-3 и сернокислый раствор перманганата калия 3) изопропилбензол
Г) пропаналь и сернокислый раствор перманганата калия 4) гексанон-3
5) гександиол-3,4
6) пропионовая кислота
17. Установите соответствие между названием вещества и продуктом, который образуется при взаимодействии этого вещества с раствором серной кислоты:
А) этилат натрия1) этанол4) уксусная кислота
Б) фенолят натрия 2) фенол5) метанол
В) ацетат натрия3) пропанол-16) пропанол-2
Г) метилпропионат
18. Задана следующая схема превращений веществ:


 CH3-NH2X (CH3-NH2-CH3)ClKOHCH3-NH-CH3Y
CH3-NH2X (CH3-NH2-CH3)ClKOHCH3-NH-CH3Y
 (CH3-NH- CH2-CH3) Cl KOH CH3-N-CH2-CH3
(CH3-NH- CH2-CH3) Cl KOH CH3-N-CH2-CH3
CH3CH3
Определите, какие из указанных веществ являются веществами X и Y.
1) хлорметан 2) хлорэтан3) хлороводород4) 2-хлорпропан 5) 1-хлорпропан
19. Из предложенного перечня выберите две каталитические реакции.
1) взаимодействие водорода с серой 2) взаимодействие лития с азотом
3) взаимодействие пропилена с водородом 4) взаимодействие пропана с хлором 5) взаимодействие азота с водородом
20. Из предложенного перечня выберите две реакции, которые при комнатной температуре протекают с наибольшей скоростью.
1) железо с конц. соляной кислотой 2) алюминий с бромом
3) железо с конц. серной кислотой 4) хром с конц. азотной кислотой
5) алюминий с конц. серной кислотой
21. Установите соответствие между уравнением реакции и изменением степени окисления окислителя в этой реакции:
А) KClO3 + Cr2O3 + 4KOH = 2K2CrO4 + KCl + 2H2O 1) +1 → 0
Б) 3NaNO2 + 2KMnO4 + H2O = 3NaNO3 + 2MnO2 + 2KOH 2) –1 → –2
В) 2KI + H2O2 = I2 + 2KOH 3) +7 → +4
4) +5 → –1
5) 0 → –2
6) +4 → +2
22. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе водного раствора этой соли:
А) NaCl1) калий 4) водород
Б) AgNO3 2) медь5) серебро
В) KBr3) хлор6) бром
Г) CuCl2
23. Установите соответствие между названием соли и ее отношением к гидролизу:
А) нитрат натрия 1) гидролизуется по катиону
Б) нитрит натрия 2) гидролизуется по аниону
В) сульфат цезия 3) гидролизуется по катиону и аниону
Г) гидрокарбонат аммония 4) гидролизу не подвергается
24. Установите соответствие между способом воздействия на равновесную систему: СН2= СН – СН2 – СН3(г)↔ СН2 = СН – СН = СН2(г) + Н2(г)
и смещением химического равновесия в результате этого воздействия:
А) увеличение давления 1) в сторону прямой реакции
Б) добавление катализатора 2) в сторону обратной реакции
В) уменьшение концентрации водорода 3) практически не смещается
Г) понижение давления
25. Установите соответствие между названиями двух веществ и реактивом, с помощью которого можно различить эти вещества:
А) пропин и бутадиен-1,3 1) бромная вода4) [Ag(NH3)2]OH
Б) пропен и пропан 2) AlCl35) лакмус
В) фенол и этандиол3) фенолфталеин
Г) уксусная кислота и пропанол-2
26. Установите соответствие между названием вещества и основной областью его применения:
А) стеарат натрия 1) используется в производстве стекла
Б) оксид кремния 2) используется в производстве бумаги
В) целлюлоза 3) используется в производстве моющих средств
4) является удобрением
5) является сырьем для производства красителей
Ответом к заданиям 27–29 является число.
27. К раствору, состоящему из 45 г воды и 15 г соли, добавили 65 г воды и 10 г той же соли. Вычислите массовую долю соли (%) в полученном растворе. (Запишите число с точностью до десятых.)
28. Определите объём (н.у.) оксида азота(II), который образуется при реакции 50 л (н.у.) азота с избытом кислорода. (Запишите число с точностью до целых.)
29. В результате реакции кремния с раствором гидроксида натрия образовалось 0,4 моль соли. Какой объём (н.у.) водорода при этом выделился? (Запишите число с точностью до сотых.)
Часть 2
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
нитрат железа(II), концентрированная азотная кислота, оксид кремния(IV), углекислый газ, гидроксид алюминия. Допустимо использование водных растворов веществ.
30. Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель.
31. Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
32. Хлорат калия прокалили в присутствии катализатора. В выделившемся газе сожгли сульфид железа(II), при этом образовался газ с резким запахом и твёрдый остаток. Газ пропустили через хлорную воду, а твёрдый остаток поместили в раствор, содержащий иодид калия и серную кислоту. Напишите уравнения четырёх описанных реакций.
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:




 X1KMnO4, H2O, 0°
X1KMnO4, H2O, 0° 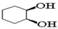 HBrX2Zn, t° X1H2O, H3PO4,t° X3K2CrO4, H2SO4X4
HBrX2Zn, t° X1H2O, H3PO4,t° X3K2CrO4, H2SO4X4
34. Смешали 58,8 г 20%-ного раствора бромида аммония и 328 г 5%-ного раствора дигидрофосфата серебра. Выпавший осадок отделили, а к оставшемуся раствору добавили 34,2 г гидроксида бария и нагрели до прекращения выделения газа. Найдите массовую долю щелочи в образовавшемся растворе.
35. При сжигании образца органического вещества массой 3,44 г получено 7,04 г углекислого газа и 2,16 мл воды. При нагревании с водным раствором гидроксида калия данное вещество подвергается гидролизу, единственным продуктом которого является соединение состава С4H7O3K. На основании данных условия задания: установите молекулярную и структурную формулу этого вещества; напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида калия.
Тренировочный вариант 2018 год
| 1 3 | 30.(2 балла) Fe(NO3)2 + 2HNO3 = Fe(NO3)3 + NO2 + H2O N+5 + 1ē → N+4 нитрат железа(II) – восстановитель Fe+2 – 1ē → Fe+3азотная кислота – окислитель 31. (2балла) Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O Al(OH)3 + 3H+ + 3NO3ˉ = Al3+ + 3NO3ˉ + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O 32. (4 балла) 1) 2KClO3 = 2KCl + 3O2↑ (в присутствии катализатора) 2) 4FeS + 7O2 = 2Fe2O3 + 4SO2↑ 3) SO2 + Cl2 + 2H2O = H2SO4 + 2HCl 4) Fe2O3 + 2KI + 3H2SO4 = 2FeSO4 + I2 + K2SO4 + 3H2O 33. (5 баллов) | |
| 1 5 3 | ||
| 1 5 | ||
| 4 5 | ||
| 4 2 3 | ||
| 2 5 | ||
| 7* | 3 5 | |
| 8* | 4 3 2 1 | |
| 9* | 6 6 4 6 | |
| 10* | 1 3 | |
| 4 2 5 | ||
| 1 4 | ||
| 1 5 | ||
| 1 2 | ||
| 3 5 | ||
| 16* | 1 3 6 6 | |
| 17* | 1 2 4 5 | |
| 18* | 1 2 | |
| 3 5 | ||
| 1 2 | ||
| 4 3 2 | ||
| 22* | 4 5 4 2 | |
| 23* | 4 2 4 3 | |
| 24* | 2 3 1 1 | |
| 25* | 4 1 1 5 | |
| 3 1 2 | ||
| 18,5 | ||
| 17,95 |
Балла)
NH4Br + AgH2PO4 = AgBr↓ + NH4H2PO4
2NH4H2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 2NH3↑ + 6H2O
2NH4Br + Ba(OH)2 = BaBr2 + 2NH3↑ + 2H2O
m(AgH2PO4) = 328 · 0,05 = 16,4 г
n(AgH2PO4) = 16,4 / 205 = 0,08 моль
m(NH4Br исх.) = 58,8 · 0,2 = 11,76 г
n(NH4Br исх.) = 11,76 / 98 = 0,12 моль – избыток
n(AgBr) = n(AgH2PO4) = 0,08 моль
m(AgBr) = 0,08 · 188 = 15,04 г
n(NH4H2PO4) = n(AgH2PO4) = 0,08 моль
n(NH4Br прореаг.) = n(AgH2PO4) = 0,08 моль
n(NH4Br ост.) = n(NH4Br исх.) – n(NH4Br прореаг.)
n(NH4Br ост.) = 0,12 – 0,08 = 0,04 моль
n(Ba(OH)2 исх.) = 34,2 / 171 = 0,2 моль – избыток
n(Ba3(PO4)2) = 1/2n(NH4H2PO4) = 0,04 моль
m(Ba3(PO4)2) = 0,04 · 601 = 24,04 г
n(NH3)[2] = n(NH4H2PO4) = 0,08 моль
m(NH3)[2] = 0,08 · 17 = 1,36 г
n(NH3)[3] = n(NH4Br ост.) = 0,04 моль
m(NH3)[3] = 0,04 · 17 = 0,68 г
n(Ba(OH)2 ост.) = n(Ba(OH)2 исх.) – n(Ba(OH)2прореаг.)
n(Ba(OH)2прореаг.) = 3/2n(NH4H2PO4) + 1/2n(NH4Br ост.)
n(Ba(OH)2 прореаг.) = 0,14 моль
n(Ba(OH)2 ост.) = 0,2 – 0,14 = 0,06 моль
m(Ba(OH)2 ост.) = 0,06 · 171 = 10,26 г
m(р-ра конечного) = 58,8 + 328 – 15,04 + 34,2 – 24,04 – 1,36 – 0,68 = 379,88 г
ω(Ba(OH)2 = 10,26 / 379,88 = 0,027, или 2,7%
Балла)
n(CO2) = 7,04 / 44 = 0,16 моль n(C) = n(CO2) = 0,16 моль
n(H2O) = 2,16 / 18 = 0,12 моль n(H) = 2n(H2O) = 0,24 моль
m(O) = m(CxHyOz) – m(C) – m(H) = 3,44 – 0,16 · 12 – 0,24 = 1,28 г
n(O) = 1,28 / 16 = 0,08 моль
x: y: z = 0,16: 0,24: 0,08 = 2: 3: 1 = 4: 6: 2 Молекулярная формула вещества – C4H6O2