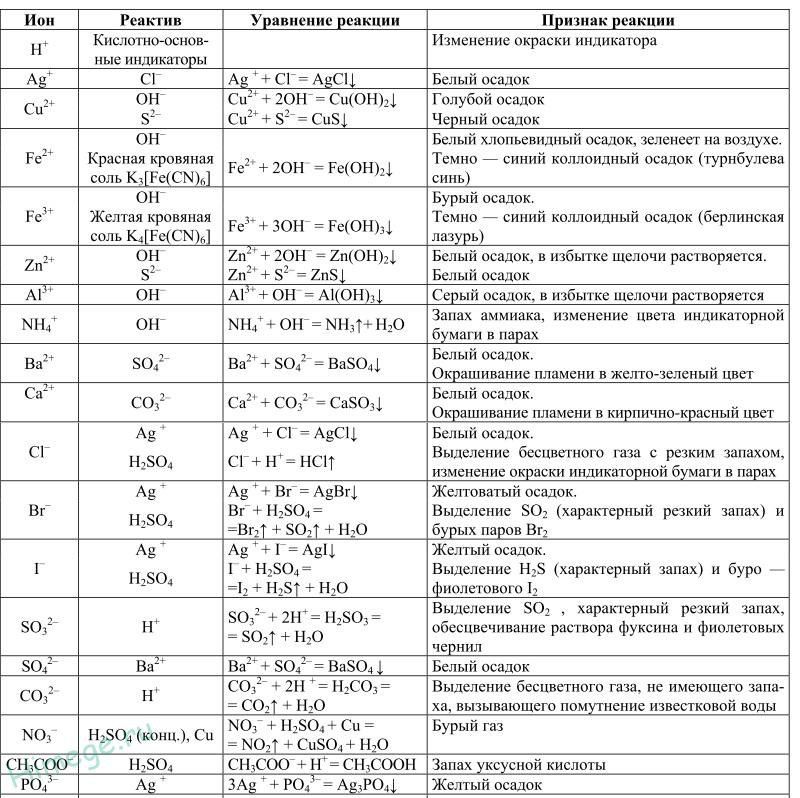
№1 Как приготовить 200 мл 0,2М раствора гидроксида калия?
№2 Как приготовить 200 г 3% раствора соды?
№3 Как приготовить 1% раствор марганцовки из 500 г 5% раствора?
V Выполните упражнения.
№1 Выпишите из списка веществ электролиты. Напишите уравнения диссоциации для каждого из них. На какие три группы по составу можно разделить эти вещества? Назовите эти электролиты.
Al2(SO4)3, C2H5OH, HCl, MgCl2, H2SO4, C6H12O6 , NaOH, Na3PO4, Ba(OH)2.
№2. Пользуясь таблицей растворимости запишите уравнение диссоциации для: а) хлорида кальция, б) сульфат натрия, в) гидроксид калия, г) фосфорная кислота, д) нитрат магния. Для кого из них можно записать несколько уравнений процесса диссоциации? Почему?
№3 Напишите формулы веществ, которые при диссоциации дают ионы: а) Ba2+и OH-, б) Ca2+и NO3-, в) H+ и NO3-. Назовите эти вещества.
№4* Пользуясь алгоритмом (см. лекцию) напишите молекулярное, полное ионное и сокращенное уравнение. Выполните вариант 1, сверьте результаты с ответами. Если все верно, или допущены 1-2 незначительные ошибки, переходите ко 2 варианту. Если ошибок много – еще раз решите 1 вариант. После выполнения 2 варианта снова проверьте работу. Если все правильно, переходите к следующему номеру, если нет – еще раз попробуйте самостоятельно написать ионные уравнения из 2 варианта
Вариант 1.
а) CaCl2 + Na2CO3 => CaCO3â + NaCl
б) HNO3 + Ba(OH)2 => Ba(NO3)2 + H2O
в) KOH + CuSO4 => Cu(OH)2â + K2SO4
Вариант ІІ.
а) FeCl2 + NaOH =>
б) Na2SO4 + BaCl2 =>
в) H3PO4 + KOH =>
г) NaCl + AgNO3 = >
д) (NH4)2SO4 + NaOH=>
е) Mg(OH)2 + HCl =>
Ответы к 1 варианту.
а) CaCl2 + Na2CO3 => CaCO3â + NaCl
Ca2+ + 2Cl- + 2 Na + + CO32- => CaCO3â +2 Na + + 2Cl-
Ca2+ + CO32- => CaCO3â
б) 2HNO3 + Ba(OH)2 =>Ba(NO3)2 + 2H2O
2H+ + 2NO3- + Ba2+ +2OH- => Ba2+ + 2NO3- + 2H2O
H++ OH- => H2O
в) KOH + CuSO4 => Cu(OH)2â + K2SO4
2K+ + 2OH- + Cu2+ + SO42- => Cu(OH)2â + 2K+ + SO42-
2OH- + Cu2+ => Cu(OH)2â
Ответы ко 2 варианту
а) FeCl2 + 2NaOH = Fe(OH)2â + 2NaCl
Fe2+ + 2Cl- + 2Na+ + 2OH- = Fe(OH)3â + 2Na++ 2Cl-
Fe2+ + 2OH- = Fe(OH)2â
б) Na2SO4 + BaCl2 = 2NaCl + BaSO4
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4â +2Na+ +2Cl-
SO42- + Ba2+ = BaSO4â
в) H3PO4 + KOH = K3PO4 + 3H2O
3H+ + PO43- + 3K+ + 3OH- = 3K+ + PO43- + 3H2O
H+ + OH- = H2O
г) NaCl + AgNO3 = AgClâ + NaNO3
Na+ + Cl- + Ag+ + NO3- = AgClâ + Na+ + NO3--
Ag+ + Cl- = AgClâ
д) (NH4)2SO4 + 2NaOH=> 2NH4OH + Na2SO4
2NH4+ + SO42- + 2Na+ + 2OH=> 2NH3á + 2H2O + Na2SO4
2NH4+ + 2OH=> 2NH3á + 2H2O
е) Mg(OH)2â + 2HCl = MgCl2 + 2H2O
Mg(OH)2â + 2H+ +2Cl- = Mg2+ + 2Cl- + 2H2O
Mg(OH)2â + 2H+ = Mg2+ + 2H2O
№5. Запишите молекулярные и ионные уравнения, которые могут протекать в растворах между веществами. Какие из этих процессов протекают необратимо? Почему?
А) сульфат железа (П) и гидроксид калия
Б) фосфорная кислота и гидроксид лития
В) сульфат натрия и хлорид железа (Ш)
Г) карбонат натрия и фосфорная кислота
Д) гидроксид алюминия и соляная кислота
Е) оксид меди (П) и азотная кислота
№6 Приведите примеры двух реакций, которые можно выразить сокращенным уравнением Запишите для них молекулярные и полные ионные уравнения:
А) Al3+ + 3OH- = Al(OH)3â
Б) H+ + OH- = H2O
№7 Какие ионы могут одновременно существовать в растворе, а какие нет? Почему?
а) Н+ и CO32- б) Cu2+ и SO42- в) Fe2+ и ОН-
№8 Когда соединения называют амфотерными? Можно ли назвать НCO3- амфотерным и почему? Ответ подтвердите уравнениями реакций.
№9. Раствор хлорида меди ядовит. С каким ионом, находящимся в растворе хлорида меди (П) связана токсичность этой соли?
№10. Какая среда будет в растворах а) гидроксида лития, б) сероводорода, г) нитрата кальция, д) хлорида хрома (П), фторида натрия. Для ответа на вопрос воспользуйтесь правилами гидролиза, поясните ответ ионными уравнениями.
№11 Какие соли нельзя хранить в виде растворов? Какие соли можно хранить в виде растворов, но концентрированных и ограниченное время? А) хлорид серебра, б) карбонат калия, в) нитрат натрия, г) сульфид аммония. Ответ поясните.
№ 12. Пользуясь формулами [H+]· [OH-] 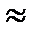 10-14моль/л и рН = -lg [H+], заполните свободные клетки
10-14моль/л и рН = -lg [H+], заполните свободные клетки
| [H+] | [OH-] | рН | рОН | кислотность среды |
| 10-3 | ||||
| 10-5 | ||||
| нейтральная |
№ 13 Вычислите чему равен рН раствора 0,001моль/л НСl?
№14 В растворе соды рН равно 9. Определите молярную концентрацию ионов водорода в этом растворе?
№15*. В результате проведенного лечения рН желудочного сока у больного изменилась от 4 до 3. Можно ли считать этот результат успешным? Во сколько раз изменилась при этом концентрация ионов водорода в желудочном соке?
VI * Напишите реферативное сообщение на одну из тем: «Водно-солевой баланс в организме человека», «Буферные системы организма», «Кислотно-щелочное равновесие – основа гомеостаза», «Ацидоз и алкалоз», «рН-метрия в медицине». Требования к написанию реферативного сообщения – в «Правилах игры».