Физические и химические свойства воды. Применение воды
ВОДА
Молекула воды состоит из атома кислорода и двух атомов водорода, присоединившихся к нему под углом 104,5°.
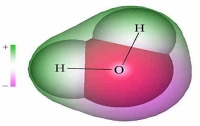
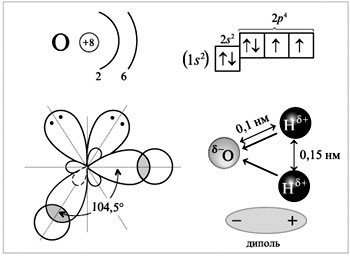 Угол 104,5° между связями в молекуле воды обусловливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры. Именно поэтому крупные водоемы не промерзают до дна, что делает возможным существование в них жизни.
Физические свойства
ВОДА, ЛЁД И ПАР,соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0С) и кипения (100С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества. Плотность воды максимальна при 4С она равна 1 г/см3. Лёд имеет меньшую плотность, чем жидкая вода и всплывает на её поверхность, что очень важно для обитателей водоёмов зимой.
Вода обладает исключительно большой теплоёмкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.
Химические свойства воды
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Под действием электрического тока вода разлагается на водород и кислород:
2H2O электрический ток= 2H2↑+ O2↑
Видео "Электролиз воды"
Угол 104,5° между связями в молекуле воды обусловливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры. Именно поэтому крупные водоемы не промерзают до дна, что делает возможным существование в них жизни.
Физические свойства
ВОДА, ЛЁД И ПАР,соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0С) и кипения (100С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества. Плотность воды максимальна при 4С она равна 1 г/см3. Лёд имеет меньшую плотность, чем жидкая вода и всплывает на её поверхность, что очень важно для обитателей водоёмов зимой.
Вода обладает исключительно большой теплоёмкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.
Химические свойства воды
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Под действием электрического тока вода разлагается на водород и кислород:
2H2O электрический ток= 2H2↑+ O2↑
Видео "Электролиз воды"

- Магний с горячей водой реагирует с образованием нерастворимого основания:
Mg + 2H2O = Mg(OH)2 + H2
- Бериллий с водой образует амфотерный оксид: Be + H2O = BeO + H2
1. Активные металлы - это:
Li, Na, K, Rb, Cs, Fr – 1 группа «А»
Ca, Sr, Ba, Ra – 2 группа «А»
2. Ряд активности металлов
 3. Щёлочь – это растворимое в воде основание, сложное вещество в состав которого входит активный металл и гидроксильная группа ОН (I).
4. Металлы средней активности в ряду напряжений стоят от Mg до Pb (алюминий на особом положении)
Видео "Взаимодействие натрия с водой"
Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
3. Щёлочь – это растворимое в воде основание, сложное вещество в состав которого входит активный металл и гидроксильная группа ОН (I).
4. Металлы средней активности в ряду напряжений стоят от Mg до Pb (алюминий на особом положении)
Видео "Взаимодействие натрия с водой"
Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
 Видео "Взаимодействие кислотных оксидов с водой"
Используя образец, запишите уравнения реакций взаимодействия:
СO2 + H2O =
SO3 + H2O =
Cl2O7 + H2O =
P2O5 + H2O (горячая) =
N2O5 + H2O =
Видео "Взаимодействие кислотных оксидов с водой"
Используя образец, запишите уравнения реакций взаимодействия:
СO2 + H2O =
SO3 + H2O =
Cl2O7 + H2O =
P2O5 + H2O (горячая) =
N2O5 + H2O =
 Помните! С водой реагируют только оксиды активных металлов. Оксиды металлов средней активности и металлов, стоящих после водорода в ряду активности в воде не растворяются, например, CuO + H2O = реакция не возможна. Видео "Взаимодействие оксидов металлов с водой"
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Смотри так же:
Лекция "Химические свойства воды" (дополнительно, по желанию)
Задание для закрепления: (выполнить письменно)
Закончить уравнения практически осуществимых реакций, назвать продукты реакции
CaO + H2O =
SO2 + H2O =
Li + H2O =
Cu + H2O =
ZnO + H2O =
Al + H2O =
Ba + H2O =
K2O + H2O =
Mg + H2O =
N2O5 + H2O =
Помните! С водой реагируют только оксиды активных металлов. Оксиды металлов средней активности и металлов, стоящих после водорода в ряду активности в воде не растворяются, например, CuO + H2O = реакция не возможна. Видео "Взаимодействие оксидов металлов с водой"
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Смотри так же:
Лекция "Химические свойства воды" (дополнительно, по желанию)
Задание для закрепления: (выполнить письменно)
Закончить уравнения практически осуществимых реакций, назвать продукты реакции
CaO + H2O =
SO2 + H2O =
Li + H2O =
Cu + H2O =
ZnO + H2O =
Al + H2O =
Ba + H2O =
K2O + H2O =
Mg + H2O =
N2O5 + H2O =
|
|
Поиск по сайту:
|

 Угол 104,5° между связями в молекуле воды обусловливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры. Именно поэтому крупные водоемы не промерзают до дна, что делает возможным существование в них жизни.
Физические свойства
ВОДА, ЛЁД И ПАР,соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0С) и кипения (100С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества. Плотность воды максимальна при 4С она равна 1 г/см3. Лёд имеет меньшую плотность, чем жидкая вода и всплывает на её поверхность, что очень важно для обитателей водоёмов зимой.
Вода обладает исключительно большой теплоёмкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.
Химические свойства воды
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Под действием электрического тока вода разлагается на водород и кислород:
2H2O электрический ток= 2H2↑+ O2↑
Видео "Электролиз воды"
Угол 104,5° между связями в молекуле воды обусловливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры. Именно поэтому крупные водоемы не промерзают до дна, что делает возможным существование в них жизни.
Физические свойства
ВОДА, ЛЁД И ПАР,соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0С) и кипения (100С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества. Плотность воды максимальна при 4С она равна 1 г/см3. Лёд имеет меньшую плотность, чем жидкая вода и всплывает на её поверхность, что очень важно для обитателей водоёмов зимой.
Вода обладает исключительно большой теплоёмкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.
Химические свойства воды
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Под действием электрического тока вода разлагается на водород и кислород:
2H2O электрический ток= 2H2↑+ O2↑
Видео "Электролиз воды"

 3. Щёлочь – это растворимое в воде основание, сложное вещество в состав которого входит активный металл и гидроксильная группа ОН (I).
4. Металлы средней активности в ряду напряжений стоят от Mg до Pb (алюминий на особом положении)
Видео "Взаимодействие натрия с водой"
Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
3. Щёлочь – это растворимое в воде основание, сложное вещество в состав которого входит активный металл и гидроксильная группа ОН (I).
4. Металлы средней активности в ряду напряжений стоят от Mg до Pb (алюминий на особом положении)
Видео "Взаимодействие натрия с водой"
Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
 Видео "Взаимодействие кислотных оксидов с водой"
Используя образец, запишите уравнения реакций взаимодействия:
СO2 + H2O =
SO3 + H2O =
Cl2O7 + H2O =
P2O5 + H2O (горячая) =
N2O5 + H2O =
Видео "Взаимодействие кислотных оксидов с водой"
Используя образец, запишите уравнения реакций взаимодействия:
СO2 + H2O =
SO3 + H2O =
Cl2O7 + H2O =
P2O5 + H2O (горячая) =
N2O5 + H2O =
 Помните! С водой реагируют только оксиды активных металлов. Оксиды металлов средней активности и металлов, стоящих после водорода в ряду активности в воде не растворяются, например, CuO + H2O = реакция не возможна. Видео "Взаимодействие оксидов металлов с водой"
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Смотри так же:
Лекция "Химические свойства воды" (дополнительно, по желанию)
Задание для закрепления: (выполнить письменно)
Закончить уравнения практически осуществимых реакций, назвать продукты реакции
CaO + H2O =
SO2 + H2O =
Li + H2O =
Cu + H2O =
ZnO + H2O =
Al + H2O =
Ba + H2O =
K2O + H2O =
Mg + H2O =
N2O5 + H2O =
Помните! С водой реагируют только оксиды активных металлов. Оксиды металлов средней активности и металлов, стоящих после водорода в ряду активности в воде не растворяются, например, CuO + H2O = реакция не возможна. Видео "Взаимодействие оксидов металлов с водой"
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Смотри так же:
Лекция "Химические свойства воды" (дополнительно, по желанию)
Задание для закрепления: (выполнить письменно)
Закончить уравнения практически осуществимых реакций, назвать продукты реакции
CaO + H2O =
SO2 + H2O =
Li + H2O =
Cu + H2O =
ZnO + H2O =
Al + H2O =
Ba + H2O =
K2O + H2O =
Mg + H2O =
N2O5 + H2O =