1. Кислотно-основные реакции. Вода обладает амфотерными свойствами. Это означает, что она может выступать как в роли кислоты, так и в роли основания. Ее амфотерные свойства обусловлены способностью воды к самоионизации:
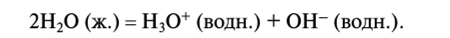
Это позволяет воде быть, с одной стороны, акцептором протона: 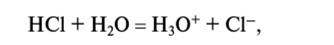 а с другой стороны — донором протона:
а с другой стороны — донором протона:
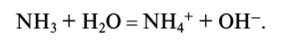
2. Окислительно-восстановительные реакции. Вода обладает способностью выступать как в роли окислителя, так и в роли восстановителя. Она окисляет металлы, расположенные в электрохимическом ряду напряжений выше олова. Например, в реакции между натрием и водой
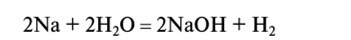
происходит следующий окислительный процесс:
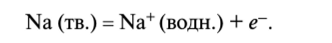
В этой реакции вода играет роль восстановителя:
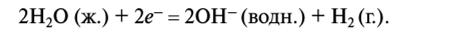
Другим примером подобной реакции является взаимодействие между магнием и водяным паром:
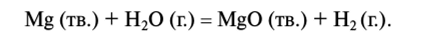
Вода действует как окислитель в процессах коррозии. Например, один из процессов, протекающих при ржавлении железа, заключается в следующем: 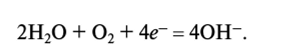
Вода является важным восстановителем в биохимических процессах. Например, некоторые стадии цикла лимонной кислоты включают восстановление воды: 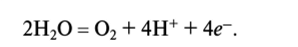
Этот процесс электронного переноса имеет также большое значение в восстановлении органических фосфатных соединений при фотосинтезе. Цикл лимонной кислоты и фотосинтез представляют собой сложные процессы, включающие ряд последовательно протекающих химических реакций. В обоих случаях процессы электронного переноса, происходящие в них, еще не полностью выяснены.
- 3. Гидратация. Молекулы воды способны сольватировать как катионы, так и анионы. Этот процесс называется гидратацией. Гидрат- ная вода в кристаллах солей называется кристаллизационной водой. Молекулы воды обычно связаны с сольватируемым ими катионом координационными связями. Обозначают содержание гидратной воды в формуле вещества: CuS04 • 4Н20.
- 4. Гидролиз. Гидролиз представляет собой реакцию какого-либо иона или молекулы с водой. Примером реакций этого типа может быть реакция между хлороводородом и водой с образованием соляной кислоты. Другой пример-гидролиз хлорида железа(Ш):
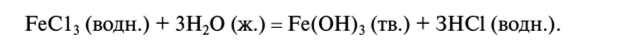
5. Взаимодействие с оксидами активных металлов: СаО + Н20 =
Са(ОН)2.
6. Взаимодействие с оксидами неметаллов: Р205 + Н20 = 2НР03.
Вода широко используется в качестве растворителя в химической
технологии, а также в лабораторной практике. Она представляет собой универсальный растворитель, необходимый для протекания биохимических реакций. Дело в том, что вода прекрасно растворяет ионные соединения, а также многие ковалентные соединения. Способность воды хорошо растворять многие вещества обусловлена полярностью ее молекул, которые при растворении в воде ионных веществ ориентируются вокруг ионов, т.е. сольватируют их. Водные растворы ионных веществ являются электролитами. Растворимость ковалентных соединений в воде зависит от их способности образовывать водородные связи с молекулами воды. Простые ковалентные соединения, как, например, диоксид серы, аммиак и хлороводород, растворяются в воде. Кислород, азот и диоксид углерода плохо растворяются в воде. Многие органические соединения, содержащие атомы электроотрицательных элементов, как, например, кислорода или азота, растворимы в воде. В качестве примера укажем этанол С2Н5ОН, уксусную кислоту СНзСООН, сахар Ci2H2206. Присутствие в воде нелетучих растворенных веществ, например хлорида натрия или сахара, понижает давление пара и температуру замерзания воды, но повышает ее температуру кипения. Присутствие в воде растворимых солей кальция и магния (жесткость воды) затрудняет ее использование в технологических процессах.
Жесткость воды подразделяется на временную (карбонатную, обусловленную присутствием гидрокарбонатов кальция Са(НС03)2
и магния Mg (НСОЗ) 2) и постоянную (некарбонатную) жесткость. По ГОСТ Р 52029—2003 жесткость выражается в градусах жесткости (°Ж), что соответствует концентрации щелочноземельного элемента, численно равной '/2 его моля, выраженной в мг/дм3 (г/м3). По величине общей жесткости различают воду мягкую (до 2 мг-экв/л), средней жесткости (2—10 мг-экв/л) и жесткую (более 10 мг-экв/л).
Жесткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка (например, жесткость волжской воды в марте — 4,3 мг- экв/л, в мае — 0,5 мг-экв/л). В подземных водах жесткость обычно выше (до 80—100 мг-экв/л) и меньше изменяется в течение года.
Растворимость газов в воде зависит от температуры и парциального давления газа над водой: чем ниже температура и выше парциальное давление газа над водой, тем выше концентрация газа в жидкости.
Растворимость большинства твердых веществ повышается при увеличении температуры. При растворении твердого вещества протекают два процесса:
- 1) процесс разрушения кристаллической решетки. Этот процесс требует затраты энергии, поэтому является эндотермическим',
- 2) процесс образования гидратов (сольватов) протекает с выделением энергии.
Общая теплота растворения складывается из теплот этих двух процессов, поэтому растворение может проходить как с повышением, так и с понижением температуры.
Раствором называется гомогенная (однородная) система, состоящая из двух или более компонентов. Необходимыми компонентами раствора являются растворитель и растворенное вещество, например, растворенный в воде сахар. В одном растворителе может находиться несколько растворенных веществ. Например, при приготовлении маринада в воде растворены сахар, соль и уксусная кислота. Растворенными веществами при одинаковом агрегатном состоянии компонентов обычно считаются компоненты, находящиеся в недостатке, в то время как компонент, находящийся в избытке, считается растворителем. При разных агрегатных состояниях компонентов раствора растворителем обычно считается компонент, агрегатное состояние которого совпадает с агрегатным состоянием раствора. Например, в случае жидких растворов твердых и газообразных веществ растворителем всегда считается жидкий компонент, независимо от концентрации растворенных веществ. Если при приготовлении раствора используют две жидкости, растворителем является та, которая находится в избытке. Если при приготовлении раствора используют воду, то растворителем является вода.