Значительное ускорение процесса при нагревании можно было бы объяснить учащением соударений реагирующих частиц. Но если бы необходимым и достаточным условием протекания реакций являлось лишь соударение частиц, то нельзя было бы объяснить различие в скоростях процессов при одинаковых концентрациях реагентов. Если бы каждое столкновение оканчивалось актом взаимодействия, то все реакции протекалибы со скоростью взрыва. Было бы непонятно также действие катализатора, его специфичность и многое другое.
Значит далеко не каждое столкновение частиц приводит к их химическому взаимодействию. Рассмотрим две реакции в нормальных условиях
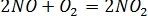
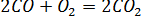
Несмотря на то, что обе реакции являются реакциями окисления и протекают в газовой фазе, в первом случае реакция протекает с большой скоростью, а во втором случае практически не идет.
Взаимодействие происходит в том случае, когда частица приближается на расстояние, при котором становится возможным перераспределение электронной плотности и возникновение новых химических связей. Следовательно, сталкивающиеся частицы должны обладать энергией, достаточной для преодоления сил отталкивания (энергетического барьера), возникающих между их электронными оболочками. Такие реакционные частицы называют активными, а энергия, необходимая для преодоления энергетического барьера – энергия активации реакции. Группировку частиц, находящихся в процессе взаимодействия (т. е. перераспределения связей), называют активным комплексом. Это неустойчивое промежуточное соединение, которое ослабляет связи атомов в исходных молекулах, т.к. для создания возможности протекания реакции нет необходимости полностью разрывать связи между атомами. Следовательно, энергия активации всегда меньше энергии связей.
Разность энергии активированного комплекса и средней энергии исходных молекул и есть энергия активации. Ее величина является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Зависимость константы скорости реакции k от энергии активации (Еа, Дж/моль) выражается уравнением Аррениуса:
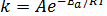
где А – предэкспоненциальный множитель или фактор частоты; R – универсальная газовая постоянная; е – основание натуральных логарифмов.
Если энергия активации меньше 40 кДж/моль, то скорость такой реакции велика; если больше 120 кДж/моль, то скорость такой реакции очень мала.
Химическое равновесие
Константа равновесия
Все химические реакции можно разделить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца - до полного израсходования одного из реагирующих веществ. Например, разложение нитрата аммония
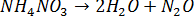
Обратимая реакция может протекать как в прямом, так и в обратном направлении. Примером обратимой реакции может служить синтез йодоводорода:
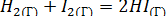
Вначале, при смешении исходных веществ, скорость прямой реакции велика, а обратной - равна нулю. Согласно закону действия масс выражение для скорости прямой реакции запишется следующим образом:
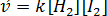
Исходные вещества в процессе реакции будут расходоваться, следовательно, скорость прямой реакции будет уменьшаться. Одновременно появятся продукты реакции, их концентрация будет возрастать. Начнет идти обратная реакция, скорость которой будет увеличиваться:
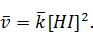
Когда скорости прямой и обратной реакций станут одинаковыми, наступит химическое равновесие.
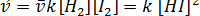
или
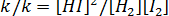
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции – K, 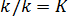 . Отсюда окончательно:
. Отсюда окончательно: 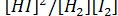 . Концентрации, приведенные в левой части этого уравнения, называются равновесными концентрациями. Константа равновесия при постоянной температуре представляет собой постоянную величину.
. Концентрации, приведенные в левой части этого уравнения, называются равновесными концентрациями. Константа равновесия при постоянной температуре представляет собой постоянную величину.
Если записать обратимую реакцию в общем виде:
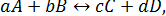
то константа равновесия выразится уравнением
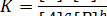
Если все компоненты реакции находятся в газообразном состоянии, то выражение константы равновесия можно записать через парциальные давления:
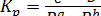
Уравнение константы равновесия показывает, что в данных условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечет за собой изменения концентрации всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Разобранные примеры являются примерами гомогенного равновесия. В качестве примера гетерогенного равновесия рассмотрим реакцию разложения известняка
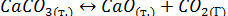
Простейшее выражение для константы равновесия этой реакции
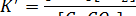
До тех пор пока твердые известняк и негашеная известь находятся в контакте с газом, их влияние на равновесие не изменяется. Следовательно, члены 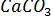 и
и 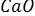 в выражении для константы равновесия остаются постоянными и могут быть включены в К. При этом получается новое выражение:
в выражении для константы равновесия остаются постоянными и могут быть включены в К. При этом получается новое выражение:
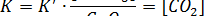
Рассмотрим еще один пример – испарение воды:
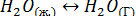
Этот процесс может нормально рассматриваться как химическая реакция. Запишем выражение константы равновесия:
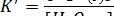
Поскольку 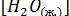 - постоянная величина (до тех пор, пока в наличии имеется жидкая вода), можно включить ее в константу равновесия. Таким образом, получается выражение
- постоянная величина (до тех пор, пока в наличии имеется жидкая вода), можно включить ее в константу равновесия. Таким образом, получается выражение 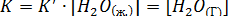 .
.
С практической точки зрения все сказанное выше означает, что концентрации чистых жидкостей и твердых веществ просто исключаются из выражений для констант равновесия. (Однако они входят в нее неявным образом).
Принцип Ле Шателье
Влияние изменения условий на положение равновесия определяется правилом, которое получило название принципа Ле Шателье.
Если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Система перейдет из одного состояния равновесия в другое, отвечающее новым условиям. Это происходит потому, что внешнее воздействиев разной степени изменяет скорость двух взаимно противоположных реакций.
Принцип Ле Шателье справедлив и для равновесных систем, не связанных с химическими превращениями (кипение, кристаллизация, растворение и т.д.).
Рассмотрим, как влияет изменение температуры на равновесие. В соответствии с принципом Ле Шателье, нагревание вызывает смещение равновесия в сторону того из двух встречных процессов, протекание которого сопровождается поглощением теплоты. Значит, повышениетемпературы вызывает возрастание константы равновесия эндотермического процесса. Естественно, что понижение температуры приводит к смещению равновесия в сторону того процесса, протекание которого сопровождается выделением теплоты. Охлаждение благоприятствует экзотермическому процессу и вызывает увеличение константы его равновесия.
Изменение давления также влияет на равновесие. При постоянной температуреконстанта равновесия не изменяется под действием давления. Однако относительные количества реагентов и продуктов под действием давленияизменяются в том направлении, которое предсказывается принципом Ле Шателье. Если повысить давление при постояннойтемпературе, объем смеси газов уменьшится, а концентрация реагентов увеличится. В этом случае повышение давления будет компенсироватьсятем, что реакция пойдет в направлении, соответствующем уменьшению суммарного числа молей присутствующих газов(в направленииуменьшения концентрации). При уменьшении давления смещение равновесие произойдет в сторону реакции с большим числом молей.
На равновесие влияет и изменение концентрации. Всоответствии с принципом Ле Шательевведение в равновесную систему дополнительных количеств какого-либо реагентавызывает сдвиг равновесия в том направлении, при котором его концентрацияуменьшается. Потом избыток исходного вещества (исходных веществ) вызывает смещение равновесия вправо. Добавление продукта (продуктов) реакции вызывает смещение равновесия влево.
Примеры решения задач
Задача 1.
Дана система 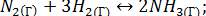 ΔH<0. Рассчитать изменение скоростей прямой и обратной химических реакций, если объем системы уменьшить в 2 раза. Определить в каком направлении сместится равновесие, если: а) в системе повысить давление; б) понизить температуру; в) увеличить концентрацию водорода.
ΔH<0. Рассчитать изменение скоростей прямой и обратной химических реакций, если объем системы уменьшить в 2 раза. Определить в каком направлении сместится равновесие, если: а) в системе повысить давление; б) понизить температуру; в) увеличить концентрацию водорода.
РЕШЕНИЕ:
В соответствии с законом действия масс запишем выражения скоростей прямой и обратной реакций: 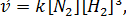
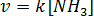 . Система гомогенная, все вещества находятся в газообразном состоянии. При уменьшении, объема системы в 2 раза концентрация реагентов возрастает также в 2 раза. Запишем новые выражения скоростей реакции:
. Система гомогенная, все вещества находятся в газообразном состоянии. При уменьшении, объема системы в 2 раза концентрация реагентов возрастает также в 2 раза. Запишем новые выражения скоростей реакции: 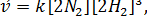
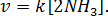 Следовательно, скорость прямой реакции возрастает в
Следовательно, скорость прямой реакции возрастает в 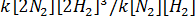 = 16 раз,
= 16 раз, 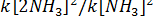 = 4 раз.
= 4 раз.
Константа равновесия данной реакции запишется следующим образом:
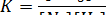
Если в системе повысить давление, то объем уменьшится, а концентрация реагентов возрастет. Следовательно, смещение равновесия произойдет в сторону реакции, уменьшающей концентрацию. Так как в данной реакции в левой части уравнения 4 моль вещества, а в правой - 2 моль, то смещение равновесия будет вправо.
Реакция экзотермическая, то есть идет с выделением тепла. Если понизим температуру, то смещение равновесия произойдет вправо, в сторону экзотермической реакции.
При увеличении концентрации водорода смещение равновесия произойдет в сторону реакции, уменьшающей концентрацию водорода, в данном случае вправо.
Задача 2.
Как изменится скорость реакции при повышении температуры от 20°С до 60°С, если температурный коэффициент скорости реакции равен 2?
РЕШЕНИЕ:
Для решения применим правило Вант-Гоффа:
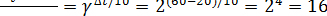
Следовательно, скорость реакции при повышении температуры возрастет в 16 раз.
Задача 3.
При температуре 50°С некоторая реакция заканчивается за 2 мин. 15 с. Принимая температурный коэффициент скорости реакции равным 3, рассчитать, через какое время закончится эта реакция, если проводить ее при 70°С?
РЕШЕНИЕ:
По правилу Вант-Гоффа рассчитаем, во сколько раз изменится скорость реакции 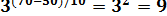 . Значит отношение
. Значит отношение 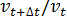 равно 9. Скорость реакции обратно пропорциональна времени реакции. Следовательно, можно записать
равно 9. Скорость реакции обратно пропорциональна времени реакции. Следовательно, можно записать 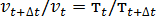 . Отсюда находим
. Отсюда находим 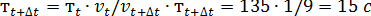 .
.
Задача 4.
Найти температурный коэффициент скорости реакции, если известно, что при повышении температуры на 80ºС скорость реакции возросла в 3000 раз.
РЕШЕНИЕ:
Применяя правило Вант-Гоффа, получим 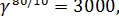
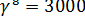 . Прологарифмировав это выражение, найдем, что
. Прологарифмировав это выражение, найдем, что 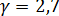 .
.
Задача 5.
Как изменится скорость прямой реакции 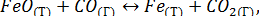 если уменьшить объем системы в 2 раза.
если уменьшить объем системы в 2 раза.
РЕШЕНИЕ:
Так как система гетерогенная, то учитывается изменение концентрации вещества в газовой фазе. В соответствии с законом действия масс скорость прямой реакции 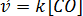 . При уменьшении объема системы в 2 раза концентрация СО увеличится также в 2 раза. Скорость прямой реакции станет
. При уменьшении объема системы в 2 раза концентрация СО увеличится также в 2 раза. Скорость прямой реакции станет 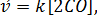 то есть увеличится в 2 раза.
то есть увеличится в 2 раза.
Задания для самостоятельной работы:
| № варианта | Определить тип системы: гомогенная или гетерогенная | Рассчитать изменения скоростей прямой и обратной химических реакций после изменения условий. Скорость, какой реакции станет больше? | Определить тип реакции: экзотермическая или эндотермическая. Решить задачу согласно условию. | Написать выражение константы равновесия для данной системы. Пользуясь принципом Ле Шателье, объяснить, в каком направлении сместится равновесие после изменения условий. |
| 1. | H2(Г)+S(T)↔H2S(Г); ΔH<0 | Уменьшить объем системы в 3 раза. | Увеличить температуру. | |
| 2. | C2H4(Г)+3O2(Г)↔2CO2(Г)+2H2O(Г); ΔH<0 | Увеличить концентрацию кислорода в 2 раза и воды в 3 раза. | Уменьшить температуру. | |
| 3. | H2(Г)+CO2(Г)↔CO(Г)+H2O(Ж); ΔH<0 | Увеличить концентрацию CO2 и H2 в 3 раза. | Уменьшить температуру. | |
| 4. | А(Г)+2В(Т)↔С(Г); ΔН>0 | Во сколько раз изменится скорость реакции, если температуру понизить на 70ºС, γ=2. | Увеличить концентрацию вещества А. | |
| 5. | Fe3O4(T)+CO(Г)↔3FeO(T)+CO2(Г); ΔH>0 | Увеличить давление в 4 раза | Уменьшить концентрацию CO2 | |
| 6. | 2SO2(Г)+O2(Г)↔2SO3(Г); ΔH<0 | Увеличить объем системы в 3 раза. | Увеличить температуру | |
| 7. | 2H2S(Г)+O2(Г)↔2H2O(Г)+2S(T) | Уменьшить объем системы в 2 раза | Увеличить концентрацию воды | |
| 8. | А(Т)+В(Г)↔С(Г) | Как изменится скорость реакции, если увеличить температуру на 40ºС, γ=3 | Увеличить концентрацию вещества С | |
| 9. | 4NH3(Г)+3O2(Г)↔2N2(Г)+6H2O(Ж); ΔH<0 | Уменьшить концентрацию аммиака и кислорода в 2 раза | Увеличить температуру | |
| 10. | PCl5(Г)↔PCl3(Г)+Cl2(Г) | Увеличить давление в 3 раза | Увеличить объем системы | |
| 11. | FeO(T)+H2(Г)↔Fe(T)+H2O(Г) | Увеличить концентрацию Н2 в 4 раза | Уменьшить объем системы | |
| 12. | СН4(Г)+СО2(Г)↔2СО(Г)+2Н2(Г); ΔН>0 | Уменьшить давление в системе в 2 раза | Увеличить температуру | |
| 13. | А2(Г)+2В(Т)↔2АВ(Г) | При температуре 50ºС реакция заканчивается за 10 с. Сколько времени будет длиться реакция при 20ºС, если γ=2 | Увеличить давление | |
| 14. | С(Т)+О2(Г)↔2СО(Г); Δ<0 | Уменьшить давление в системе в 3 раза | Уменьшить температуру | |
| 15. | MgCO3(Т)↔MgO(T)+CO2(Г); ΔH>0 | Уменьшить концентрацию СО2 в 4 раза | Увеличить температуру | |
| 16. | 3Fe(T)+4H2O(Г)↔Fe3O4(T)+4H2(Г) | Увеличить объем системы в 2 раза. | Увеличить концентрацию Н2 | |
| 17. | СОCl2(Г)↔СО(Г)+Cl2(Г) | Уменьшить давление в системе в 3 раза | Увеличить температуру | |
| 18. | 4СО(Г)+2SO2(Г)↔2S(T)+4CO2(Г); ΔH<0 | Уменьшить объем системы в 2 раза. | Увеличить температуру | |
| 19. | А(Г)+В(Г)↔2С(Т) | Как изменится скорость реакции, если увеличить температуру на 60ºС, γ=2 | Уменьшить концентрацию вещества А | |
| 20. | HCl(Г)+O2(Г)↔Н2О(Г)+2Cl2(Г); ΔН<0 | Увеличить концентрацию исходных веществ в 4 раза | Уменьшить температуру | |
| 21. | NH3(Г)+HCl(Г)↔NH4Cl(Т) | Уменьшить концентрацию аммиака в 3 раза | Увеличить давление | |
| 22. | 3N2O(Г)+3NH3(Г)↔4N2(Г)+3Н2О(Г); ΔН<0 | Увеличить давление в системе в 2 раза | Уменьшить температуру | |
| 23. | C2H5OH(Ж)+3О2(Г)↔2СО2(Г)+3Н2О(Ж); ΔН<0 | Уменьшить давление в системе в 2 раза | Увеличить температуру | |
| 24. | А(Т)+2В(Г)↔С(Т) | Во сколько раз увеличится скорость реакции при повышении температуры на 30ºС, γ=3. | Уменьшить концентрацию вещества В в 2 раза | |
| 25. | S(T)+O2(Г)↔2SO2(Г); ΔH<0 | Увеличить концентрацию кислорода в 3 раза | Уменьшить температуру | |
| 26. | CH4(Г)+4Cl2(Г)↔CCl4(Ж)+4HCl(Г); ΔH<0 | Уменьшить концентрацию в 2 раза | Увеличить температуру | |
| 27. | А(Г)+В(Г)↔С(Ж) | При температуре 70ºС реакция заканчивается за 15 с. Сколько времени будет длиться эта реакция при 40ºС, γ=2 | Увеличить концентрацию исходных веществ в 5 раз | |
| 28. | N2(Г)+О2(Г)↔2NO(Г); ΔH>0 | Уменьшить давление в системе в 3 раза | Увеличить температуру | |
| 29. | 2H2(Г)+О2(Г)↔2Н2О(Г); ΔH<0 | Уменьшить объем системы в 2 раза. | Увеличить температуру | |
| 30. | N2(Г)+3Н2(Г)↔2NH3(Г); ΔH<0 | Увеличить давление в системе в 3 раза | Увеличить концентрацию аммиака в 5 раз |
Список использованной литературы
1. Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия, 1981. 632 с.
2. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.: Мир, 1982. 652 с.
3. Глинка Н. Л. Общая химия. Л.: Химия, 1987. 702 с.
4. Глинка Н. Л. Задачи и упражнения по общей химии. Л.: Химия, 1987. 260 с.
5. Хомченко Г. П. Химия. Для подготовительных отделений. М.: Высшая школа, 1980. 368 с.