Химическая кинетика
Одна из основных задач химии – изучение влияния различных факторов на скорость и механизм химических реакций. Этому посвящен особый раздел химии – химическая кинетика.
Реакции могут быть гомогенными и гетерогенными. Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком растворе). Гетерогенные реакции протекают в неоднородной среде – между веществами, которые находятся в разных фазах (твердой и жидкой, газовой и жидкой и т. д.).
Таким образом, гомогенные реакции происходят равномерно во всем объеме, заполненном реагентами, гетерогенные – только на некоторых пограничных поверхностях – на границе раздела фаз.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела (для гетерогенных реакций).
Скорость реакции обычно характеризуют изменением концентрации какого-либо из исходных веществ или конечных продуктов реакции в единицу времени. Размерность – моль/(л ∙ с).
Если в момент времени т1 и т2 концентрации одного из исходных веществ равны С1 и С2, то средняя скорость v в интервале времени от т1 до т2 можно выразить как
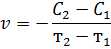
Поскольку концентрация реагирующего вещества во времени уменьшается, то С2 - С1 < 0. Но скорость не может быть отрицательной величиной, поэтому в правой части уравнения ставится «- ». Если скорость определяют по увеличению концентрации продукта реакции, то она положительна. В общем случае
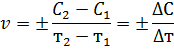
Эта формула выражает так называемую среднюю скорость реакции. Мгновенная скорость реакции выражается первой производной концентрации по времени
|
|
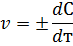
Иногда на практике применяется так называемая относительная скорость. Эта величина, обратная времени 1/т. Ее размерность 1/с.
Скорость реакции зависит от многих факторов. На нее влияют: природа и концентрация реагентов, давление (для реакции с участием газов), температура, катализатор и т. д.
Влияние концентрации на скорость реакции
Закон действия масс. Основным законом химической кинетики является открытый в 1864-67 гг. норвежским ученым Гульдбергом и Вааге закон действия масс.
Согласно этому закону скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам.
Так, для реакции типа
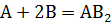
закон действия масс выражается следующим образом:
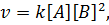
где [A] и [B] – концентрации вступающих в реакцию веществ, а k – константа скорости реакции. Величина k численно равна скорости реакции, когда концентрации реагирующих веществ равны единице. Константа скорости реакции зависит от природы реагирующих веществ и от температуры.
В случае реакции, протекающей в гомогенной среде,
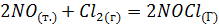
выражение скорости реакции запишется следующим образом: 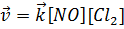
Для гетерогенной реакции
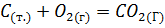
выражение скорости реакции можно записать так: 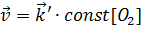 ,
, 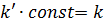 , тогда
, тогда 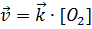 .
.
В этом случае скорость реакции зависит только от изменения концентрации кислорода, а концентрация углерода входит в константу скорости реакции, т.к. представляет собой постоянную величину.
Таким образом, в выражение скорости гетерогенных реакцийвходят концентрации только тех веществ, которые находятся в газообразном или жидком состояниях.
|
|
Следует иметь в виду, что закон действия масс применим для элементарных реакций (в системе протекает толькоодин процесс, и уравнение реакции раскрывает ее механизм). Большинство реакций являютсясложными ипредставляют собой суммарный результат нескольких элементарных процессов. Обычная запись этихреакций, какправило, не отражает их реальный механизм, и закон действия масс применяется к ним формально.