Тема 10. ОКСИКИСЛОТЫ. АЛЬДЕГИДО– И КЕТОКИСЛОТЫ
Оксикислотами (или гидроксикислотами) называют соединения, которые содержат в молекуле гидроксильную и карбоксильную группы. Оксикислоты различаются по основности – числу карбоксильных групп, и атомности – числу гидроксильных групп, включая гидроксил карбоксильной группы. Простейшая оксикислота НО-СН2-СООН является одноосновной и двухатомной.
Названия оксикислот производят, прибавляя приставку окси – (гидрокси-) к названию соответствующей кислоты. Положение ОН- группы по отношению к карбоксильной обозначают буквой греческого алфавита (α-, β-, γ- и т.д.) или цифрой. Многие оксикислоты имеют правильные названия. Например:
α α
НО – СН2 – СООН СН3 – СН – СООН
|
ОН
Гликолевая кислота Молочная кислота
(α-окиуксусная, (α-оксипропионовая,
2-оксиэтановая) 2-оксипропановая)
В ряду оксикислот структурная изомерия связана с изомерией углеродной цепи и положением ОН – группы относительно карбоксильной (α-, β-, γ- и т.д. оксикислоты).
В водных растворах оксикислоты диссоциируют:

 О О
О О
 СН3 – СН ← С(q+) → СН3 – СН – С + Н+
СН3 – СН ← С(q+) → СН3 – СН – С + Н+
↓ О←Н ← | О-
OH OH
-JOH
Пировиноградная Пируват – анион
кислота
По сравнению с незамещёнными карбоновыми кислотами оксикислоты имеют более высокую константу диссоциации, т.е. обладают более сильными кислотными свойствами (рКа молочной кислоты – 3,8).
Оксикислоты проявляют свойства карбоновых кислот и спиртов, а также некоторые специфические свойства, обусловленные взаимным влиянием СООН и ОН групп.
Примеры реакций:
НО – СН2 – СООН 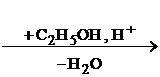 НО – СН2 – СООС2Н5
НО – СН2 – СООС2Н5
Гликолевая Этиловый эфир
кислота гликолевой кислоты
НО – СН2 – СООН + (СН3СО)2О – СН3СООН → СН2 – СООН
|
Глаколевая Уксусный О – С – СН3
кислота ангидрид ||
О
Ацетилглико-
левая кислота
СН3 – СН – СООН + О 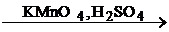 СН3 – С – СООН Н2О
СН3 – С – СООН Н2О
| ||
OH O
Молочная кислота Пировиноградная
кислота
К специфическим свойствам относятся реакции, протекающие при нагревании оксикислот.
α – Оксикислоты при нагревании с разбавленной серной кислотой разлагаются до альдегидов и муравьиной кислоты:


 О О О
О О О


 СН3 – СН – С
СН3 – СН – С 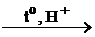 СН3 – С + Н – С
СН3 – С + Н – С
| ОН Н ОН
OH
Молочная Уксусный Муравьиная
кислота альдегид кислота
Оксикислоты при нагревании легко отщепляют воду - дегидратация. В зависимости от положения гидроксильной группы (α-, β-, γ-, δ) образуются различные вещества.
α- Оксикислоты при нагревании образуют циклические сложные эфиры – лактозы:






 СН3 – СН – О – Н НО – С = О
СН3 – СН – О – Н НО – С = О  СН3 – СН – О – С =О
СН3 – СН – О – С =О
 |
+ +2H2O



О = С – ОН Н–О–СН – СН3 О = С – О – СН –СН3
 |
Молочная кислота Лактид молочной кислоты
β-Оксикислоты при нагревании отщепляют молекулу воды за счёт спиртового гидроксила и подвижного водорода у α-углеродного атома и превращаются в непредельные кислоты:
β α
СН3 – СН – СН – СООН  СН3 – СН = СН – СООН + Н2О
СН3 – СН = СН – СООН + Н2О


 | |
| |
ОН Н
β  -оксимасляная кислота Кротоновая кислота
-оксимасляная кислота Кротоновая кислота
γ – и δ – Оксикислоты образуют внутренние сложные эфиры – лактоны:
 Н2С СН2
Н2С СН2
СН2 – СН2 – СН2 – С = О
 | | Н2С С=О
| | Н2С С=О
О – Н НО – Н2О
О
γ – Оксимасяная Лактон γ – оксимасляной
кислота кислота (γ-бутиролактон).
Многоосновные оксикислоты
Яблочная кислота (α-оксиянтарная, 2-оксибутандиовая).
НООС – СН – СН2 – СООН
|
ОН
Винная кислота (α, α' – диоксиянтарная, 2,3 - диоксибутандиовая).
НООС – СН – СН – СООН
| |
OH OH
Лимонная кислота. В её молекуле три карбоксильные группы и один спиртовый гидроксил:
ОН
|
НООС – СН2 – С – СН2 – СООН
|
COOH
Оксикислоты (альдегидо- и кетокислоты) – соединения, содержащие в молекуле карбоксильную и карбонильную группы.
Различают: α-, β-, γ- и другие оксокислоты:
 О α α
О α α
 С – СООН СН3 – С – СООН
С – СООН СН3 – С – СООН
Н ||
О
Глиоксиловая Пировиноградная
кислота кислота
(оксоэтановая) (2-оксопропановая)
γ γ
СН3 – С – СН2 – СООН СН3 – С – СН2 – СН2 – СООН
|| ||
O О
Ацетоуксусная кислота Левулиновая кислота
(3-оксобутановая) (4-оксопентановая)
Оксокислоты проявляют свойства карбоновых кислот и оксосоединений (альдегидов и кетонов).


 Пировиноградная кислота и β-оксокислоты при нагревании разлагаются с отщеплением оксида углерода (IV) – реакция декарбоксилирования:
Пировиноградная кислота и β-оксокислоты при нагревании разлагаются с отщеплением оксида углерода (IV) – реакция декарбоксилирования:
СН3 – С – СОО Н → СН3 – С – Н + СО2
 || ||
|| ||
O O
Пировиноградная Уксусный
кислота альдегид
 |
СН3 – С – СН2 – СООН → СН3 – С – СН3 + СО2
 || ||
|| ||
O O
Ацетоуксусная Ацетон
кислота
Ацетоуксусный эфир (этиловый эфир ацетоуксусной кислоты)
СН3 – С – СН2 – СООНС2Н5 представляет собой смесь двух
||
O таутомеров (кетонной и енольной форм), переходящих друг в друга:
 СН3 – С – СН – СООС2Н5 ↔ СН3 – С = СН – СООС2Н5
СН3 – С – СН – СООС2Н5 ↔ СН3 – С = СН – СООС2Н5





 || | |
|| | |
O ← H O H

 Кетонная форма Енольная форма
Кетонная форма Енольная форма
В химических реакциях ацетоуксусный эфир образует производные обеих форм, например:
OH
|
СН3 – С – СН2 – СООС2Н5 + HCN → CH3 – C – CH2 – COOC2H5
|| |
O CN
Оксинитрил
СН3 CH3
 | |
| |
С – О – Н + Cl – CO – CH3 → C – O – CO – CH3 + HCl
|| Ацетилхлорид ||
CH –COOC2H5 CH – COOC2H5
Br Br
| |
CH3 – CH = CH – COOC2H5 + Br2 →CH3 – CH – CH – COOC2H5
| |
OH OH
Оптическая изомерия
(оптическая активность)
Способность веществ вращать плоскость поляризации света называется оптической активностью, а вещества, обладающие таким свойством оптически активными веществами.
Оптической активностью обладают ассиметричные молекулы, которые содержат атом углерода, связанный с четырьмя различными заместителями. Такой атом углерода называется ассиметрическим и обозначается знаком С*.
Молекула, содержащая асиметрический атом углерода, может существовать в виде стереоизомеров, различающихся расположением в пространстве заместителей вокруг ассиметрического атома углерода. Эти изомеры относятся друг к другу как предмет к своему зеркальному отражению. Молекулы их в пространстве не могут быть совмещены. Такие изомеры называются оптическими изомерами или антиподами, но чаще всего энантиомерами (от греч. «энантио» - противоположный). Один изомер вращает плоскость полиризации вправо и называется правовращающим (обозначается знаком «+»), другой – на такой же угол влево и называется левовращающим (обозначается знаком «–»).
Физические и химические свойства оптических изомеров одинаковы. Смесь равного числа молекул лево- и правовращающих изомеров (антиподов) называется рацематом и не обладает оптической активностью.
Число оптических изомеров равно 2 n, где n – число асимметрических атомов углерода.
Простейший пример оптически активного вещества – молочная кислота:
Н
|
CH3 – C – COOH
|
OH
В молекуле имеется асимметрический атом углерода, поэтому существуют два оптических изомера (антипода) молочной кислоты – право- и левовращающего.
Для изображения оптических изомеров пользуются так называемыми проекционными формулами Фишера. Углеродную цепь располагают вертикально. Старшая карбоксильная группа пишется вверху, атом водорода и ОН. Группа пишется слева и справа от асимметрического атома углерода:
 |

 СООН СООН
СООН СООН

 Н ОН НО Н
Н ОН НО Н
СН3 СН3
(+) – Молочная (–) – Молочная
кислота кислота
Винная кислота НООС – С(*)НОН – С(*)НОН – СООН содержит два асимметрических атома углерода и существует в виде нескольких оптических изомеров:
 |



 СООН СООН СООН СООН
СООН СООН СООН СООН



 Н ОН НО Н Н ОН НО Н
Н ОН НО Н Н ОН НО Н

 ≡
≡



 НО Н Н ОН Н ОН НО Н
НО Н Н ОН Н ОН НО Н
СООН СООН СООН СООН
(+) (–) Мезо-
(+) и (–) – Винные кислоты – оптические антиподы (энантиомеры), а мезовинная кислота – их диастереомер. Так как мезовинная кислота имеет плоскость симметрии (обозначена в формулах пунктирной линией), она оптически неактивна.
Встречающаяся в природе оптически неактивная виноградная кислота является рацематом (+) и (–) - винных кислот.