Занятие № 5
Методические указания для студентов
ТЕМА: Химическая кинетика и катализ.
ЦЕЛЬ: Изучить основные законы кинетики, усвоить представления о фармакокинетике. Экспериментально оценить влияние концентрации и температуры на скорость химической реакции.
Теоретические вопросы
1. Понятие о скорости химической реакции, средняя скорость реакции в интервале, истинная скорость.
2. Классификации реакций, применяющихся в кинетике: реакции гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряжённые, цепные).
3. Молекулярность и порядок реакции. Закон действующих масс. Влияние различных факторов на скорость химической реакции. Зависимость скорости реакции от концентрации. Фармакокинетика.
4. Кинетические уравнения реакций нулевого, первого, второго порядков. Размерность константы скорости. Период полупревращений. Экспериментальные методы определения скорости и константы скорости реакции.
5. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации. Понятие о теории активных соударений и о теории переходного состояния.
6. Катализ. Катализаторы. Механизм их действия. Основы гомогенного и гетерогенного катализа. Энергетический профиль каталитической реакции.
7. Особенности каталитической активности ферментов. Уравнение Михаэлиса-Ментен и его анализ.
Обучающие задачи
Задача 1. Гомогенная реакция 2NO + Cl2 = 2NOCl протекает по простому механизму. Как измениться скорость прямой реакции, когда концентрация оксида азота (II) увеличиться в 2 раза?
Решение:
V = K [NO]2 [Cl2] обозначим [NO] = a, [Cl2] = b.
V1 = Ka2b, при увеличении концентрации [NO] = 2a, [Cl2] = b.
V2 = K[2a]2 [b] = 4Ka2b

Ответ: увеличится в 4 раза.
Задача 2. Константа скорости мономолекулярной реакции равна 8∙10-3 мин -1. Вычислите время, за которое начальная концентрация уменьшиться на 1/4.
Решение:


Примем начальную концентрацию за 1, тогда Х=1/4=0,25, С-Х=1-0,25=0,75

Ответ: 35,65 мин.
Задача 3. Денатурация некоторого вируса является процессом первого порядка с энергией активации 630 кДж/моль. Период полураспада при температуре 300С (303 К) равен 5ч. Определите константу скорости реакции при этой температуре. Вычислите период полураспада при 400 (313 К).
Решение:





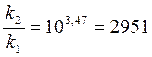
K2 = 2951×0,138 = 407,2 ч-1;  или 6,12 сек
или 6,12 сек
Ответ: К2 = 407,2 ч-1, t2 = 6,12 сек
Задача 4
Было найдено, что количество свинца 206Рb, содержащегося в образце урановой руды из Восточной Сибири, эквивалентно (в молях) 41,6% урану (238U). Принимая во внимание, что весь свинец происходит из урана (период полураспада урана равен 4,5х109 лет), вычислите примерный возраст образца урановой руды.
Решение:
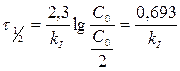

Возраст образца

Ответ: 3,5 миллиарда лет
Задачи для самостоятельного решения
Задача 1. Константа скорости аспирина (t=250С) составляет: при рН = 2,5, k=0,001час-1, при рН=11,0, k=10сут-1. Рассчитайте период полупревращения реакции гидролиза аспирина при различных рН.
Задача 2. Фармпрепарат при 500 С в воде подвергается термическому разложению по уравнению первого порядка с константой скорости 0,071 мин-1. Сколько времени нужно нагревать раствор при 500 С для того чтобы исходная концентрация вещества, равная 0,01 моль/л уменьшилась до 0,001 моль/л.
Ответ: 32,4 мин.
Задача 3. Из 1 кг сахарозы при превращении её в глюкозу и фруктозу в присутствии воды и фермента, сахарозы за 5 часов осталось 0,6 кг. Какое количество сахарозы останется через 2ч. 20 мин. Определите время полураспада.
Ответ: 79%, 6,8 часа.
Задача 4. В мономолекулярной реакции половина вещества распадается за один час. Найти время необходимое для распада 75% начального количества.
Задача 5. При увеличении температуры на 600 скорость реакции возрастает в 2000 раз. Определить температурный коэффициент реакции.
Задача 6. При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий-192. Какая часть введённого радионуклида останется в опухоли через 10 суток, если его распад подчиняется кинетическому уравнению 1-го порядка? Период полураспада иридия-192 составляет 74,08 суток.
Задача 7. Для определения объёма эритроцитарной массы используют препарат человеческих эритроцитов, меченый радионуклидом хром-51. Сколько времени должно пройти с момента ввода препарата в кровяное русло, чтобы в организме осталось 1/10 часть введенного изотопа хрома? Период полураспада хрома-51 составляет 27,703 суток.
Задача 8. Резерфорд установил, что распад 1 г радия образует 1,107 мм3 гелия в сутки при стандартных условиях, испуская при этом 3,7х1011 α-частиц в секунду. Вычислите, исходя из этих данных, число Авогадро. В чем может состоять причина отклонений от известного Вам значения числа Авагадро?
Ответ: Из данных задачи расчетное значение числа Авагадро равно 6,46 х 1023.
Задача 9
При авариях на АЭС появляется изотоп 131J, период полураспада составляет 8 сут. Сколько потребуется времени, чтобы активность радионуклида составила 25% от начальной?
Ответ: 16 сут.
Тестовые вопросы
1. При 0°С гранула железа растворяется в соляной кислоте за 20 мин. Если температурный коэффициент реакции равным 2, то такой же по массе кусочек железа растворится при 20°С за _____ минут.
1) 5 2) 12 3) 60 4) 10
2. Если температурный коэффициент скорости химической реакции равен 2, то при повышении температуры от 200С до 500С скорость реакции …
1) увеличивается в 8 раз 3) уменьшается в 2 раза
2) увеличивается в 6раз 4)уменьшается в 4 раза
3. Температурный коэффициент реакции равен 3. Во сколько раз увеличивается скорость реакции при повышении температуры на 200С
1) в 1,5 раза 2) в 3 раза 3) в 6 раз 4) в 9 раз
4. Кинетическое уравнение для реакций I-го порядка имеет вид:
1)  2)
2) 
3)  4)
4) 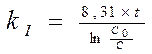
5. Кинетическое уравнение для реакций II-го порядка имеет вид:
1)  2)
2) 
3)  4)
4) 
6. Согласно закону Вант-Гоффа при повышении температуры на 10ºС скорость химической реакции возрастет в:
1) 5-6 раз 2) 2-4 раза 3) 10 раз 4) 1,75 раза
7. Энергия активации – это …
1) кинетическая энергия
2) потенциальная энергия
3) энергия, образующаяся при столкновении молекул
4) избыточная энергия, которую необходимо передать 1 моль вещества, чтобы перевести все молекулы в активное состояние
8. Как изменится скорость химической реакции при увеличении температуры на 20ºС? При температурном коэффициенте равном 4
1) возрастет в 16 раз 2) сначала увеличится в 3 раза затем уменьшится в 1,5 раза
3) уменьшится в 2 раза 4) не изменится