Лекция 5. Химическое равновесие
1 Химическое сродство и его критерии
2 Уравнение изотермы химической реакции Вант-Гоффа, константа равновесия
3 Описание равновесий в реальных системах
4 Зависимость констант равновесия от температуры и давления
Химическое сродство и его критерии.
Химическое сродство – способность веществ вступать в химическую реакцию.
На разных этапах истории развития физической химии были предложены следующие критерии химического сродства:
а) Скорость химической реакции. Чем больше скорость химической реакции, тем больше сродство реагирующих веществ. Данный критерий оказался неверным, так как скорость химической реакции сама является функцией многих переменных (особенно зависит от присутствия наличия катализаторов);
б) Количество теплоты, выделяющееся при проведении химической реакции. Принцип Бертло (1867) и Томсена (1853) также недостаточин в качестве критерия, поскольку существует значительное число самопроизвольных эндотермических реакций;
в) Согласно современным представлениям оценка химического сродства должна проводиться на основе общих термодинамических критериев возможности самопроизвольного протекания процесса, т.е. по ∆FV,T и ∆GP,T. Движущей силой любой химической реакцией является энергия Гиббса. При этой оценке учитывается теплота Q и энтропийный фактор T∆S. Принцип Бертло-Томсена справедлив, когда T и ∆S малы. Однако роль T∆S возрастает при увеличении температуры. ∆GP,T (изобарный потенциал системы) уменьшается, когда в ней самопроизвольно протекает химическая реакция. При достижении химического равновесия ∆G – min.
Для того, чтобы оценить возможность самопроизвольного протекания реакции и охарактеризовать удаленность системы от состояния равновесия, нужно рассчитать ∆G при превращении стехиометрических количеств веществ в реакционной смеси при p, T = const.
При многих химических превращениях процессы могут протекать как в прямом, так и в обратном направлениях. Такие реакции называются обратимыми. Реакция, протекающая слева направо, называется прямой, а идущая справа налево – обратной.
Впервые идея обратимости химических реакций возникла у Бертолле (1799). Обратимые химические реакции были подробно изучены русским ученым Н. Н. Бекетовым (1865), который установил влияние концентрации реагирующих веществ на направление и скорость химического процесса. Он вплотную подошел к формулировке закона действующих масс. Эта формулировка в более общем виде была дана позднее норвежцами Гульдбергом и Вааге (1876): скорость химической реакции пропорциональна действующим массам. Под действующими массами авторы понимали концентрации веществ, участвующих в химических реакциях.
Химическое равновесие является динамическим по характеру, т.к. скорости прямой и обратной реакции одинаковы. Например, реакция этерификации обратима, когда V1 = V2.
|
В равновесной системе нет ни продуктов реакции, ни исходных реагентов, все вещества одновременно участвуют в создании химического равновесия.
При постоянных внешних условиях – концентрация, давление, температура – химическое равновесие сохраняется как угодно долго. Однако изменение хотя бы одного из указанных факторов немедленно ведет к нарушению химического равновесия, смещая его в ту или иную сторону. Влияние различных факторов на смещение химического равновесия отражается принципом Ле Шателье(1884): система, находящаяся в равновесии, реагирует на внешнее воздействие (т.е. на изменение P, C, T) таким образом, чтобы уменьшить это воздействие.
Согласно этому принципу повышение температуры смещает химическое равновесие в сторону эндотермической реакции, а повышение давления смещает равновесие в сторону уменьшения объема. Поэтому, например, реакцию промышленного синтеза аммиака:
N2 + 3H2 ↔ 2NH3 + 92 кДж
целесообразно проводить с применением высоких давлений при оптимальных температурах.
Уравнение изотермы химической реакции Вант-Гоффа, константа равновесия.
Итак, на смещение химического равновесия влияют:
а) Т;
б) р;
в) с;
г) электрические и магнитные поля, другие факторы.
Химическая термодинамика позволяет количественно выразить эти влияния.
Пусть химическая реакция aA + bB → cC + dD протекает самопроизвольно в изобарно-изотермических условиях (p и T = const), причем А, В, С, D – идеальные газы. РА, РВ, РС, РD давление компонентов практически не меняется
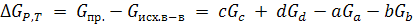 (6.1)
(6.1)
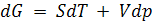
В изотермических условиях при Т = const
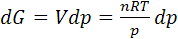 (6.2)
(6.2)
Интегрируя уравнение (6.2) от G0 до G и от р0 до р получим
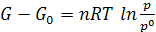
Или 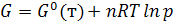 (при p0 = 1 атм) (6.3)
(при p0 = 1 атм) (6.3)
Используя последнее уравнение получим:
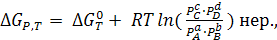 (6.4)
(6.4)
Индекс „нер.” Указывает, что давления компонентов равны их парциальным давлениям в неравновесной газовой смеси, а
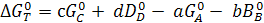 (6.5)
(6.5)
Уравнение (6.4) называется уравнением изотермы химической реакции, или изотермой Вант-Гоффа. Если pA = pB =pC =pD = 1атм., то ∆GP,T = ∆G0T
При p и T = const имеет место изобарно-изотермический процесс. В условиях термодинамического равновесия ∆GP,T = 0. В этом состоянии давления всех компонентов – равновесные, т.е.
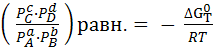 (6.6)
(6.6)
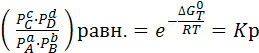 (6.7)
(6.7)
Правая часть уравнения зависит только от температуры Т. Следовательно, и левая часть является постоянной при постоянной температуре. Она называется константой равновесия (Кр).
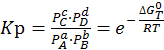 (6.8)
(6.8)
Константа равновесия выражена через равновесные давления компонентов.
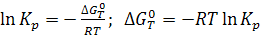 (6.9)
(6.9)
Последнее уравнение является частным случаем изотермы химической реакции. После оценки 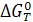 термодинамическим способом можно рассчитать константу равновесия, не проводя эксперимента.
термодинамическим способом можно рассчитать константу равновесия, не проводя эксперимента.
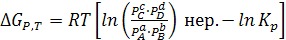 (6.10)
(6.10)
Если известна Кр, то можно оценить знак выражения в квадратных скобках последней формулы:
а) Первое слагаемое < второго, ∆Gp,T < 0, реакция самопроизвольно протекает слева направо;
б) Первое слагаемое > второго, ∆Gp,T > 0, протекает обратная химическая реакция;
в) Сумма в скобках = 0, ∆Gp,T = 0, имеет место состояние химического равновесия.
При р и V = const, изохорно-изотермический процесс, константа равновесия (Кс) выражается через равновесные концентрации компонентов. По аналогии с уравнением (6.4) имеем:
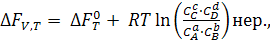 (6.11)
(6.11)
где 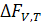 − изменение энергии Гельмгольца при параметрах V,T;
− изменение энергии Гельмгольца при параметрах V,T;
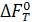 – изменение энергии Гельмгольца при стандартных условиях.
– изменение энергии Гельмгольца при стандартных условиях.
В условиях химического равновесия при ∆FV,T = 0
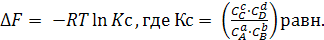 (6.12)
(6.12)
Константа Кс выражена через равновесные концентрации компонентов.
Полученные соотношения для констант Кр и Кс выражают закон действующих масс Гульдберга и Вааге.
Связь между Кр и Кс может быть установлена через уравнение состояния идеального газа:
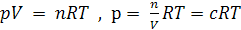 (6.13)
(6.13)
Следовательно 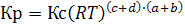 (6.14)
(6.14)
Кр = Кс, когда химическая реакция идет без изменения числа молей в газовой фазе, т.е. при c + d = a + b
Учитывая уравнение (6.11) и (6.12) получим
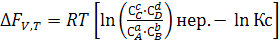 (6.15)
(6.15)
Из уравнения изотермы (6.9) следует, что 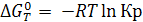
а) Если К < 1, 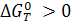 , реакция не протекает самопроизвольно в стандартных условиях. Принципиальная осуществимость процесса определяется знаком ∆G (в таблицах приводится значение ∆G0);
, реакция не протекает самопроизвольно в стандартных условиях. Принципиальная осуществимость процесса определяется знаком ∆G (в таблицах приводится значение ∆G0);
б) ∆G0  0, равновесие смещается в сторону распада химического соединения;
0, равновесие смещается в сторону распада химического соединения;
в) ∆G0  0, т.е. Кр очень велика и реакция осуществима не только в стандартных условиях, но и в любых других условиях.
0, т.е. Кр очень велика и реакция осуществима не только в стандартных условиях, но и в любых других условиях.
Расчет Кр по таблицам стандартных величин.
Константа равновесия Кр может быть рассчитана из термодинамических данных при стандартных условиях по формуле:
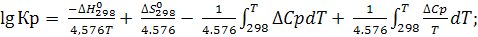 (6.16)
(6.16)
При расчете константы равновесия возможны три случая приближения:
1) Если ∆Ср =0, тогда ограничимся двумя первыми слагаемыми;
2) Если ∆Ср = ∆Ср298
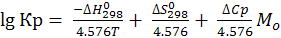 ; (6.17)
; (6.17)
где 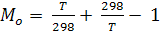
Величины Mo протабулированы (в зависимости от Т) в справочниках физико-химических величин.
3) ∆Ср – зависит от температуры и применяется первая расчетная формула (6.16)
Ниже приведены величины универсальной газовой постоянной R (в различных размерностях)
1) 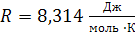
| 3) 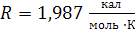
|
2) 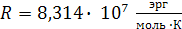
| 4) 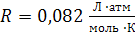
|
6.3. Описание равновесий в реальных системах.
Используя уравнение изотермы химической реакции Вант-Гоффа, закона действующих масс и др. можно описать равновесие в реальных системах, используя понятия летучесть, фугитивность (вместо давления), активность (вместо концентрации).
|
Если 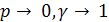
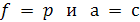
Учитывая это, уравнения (6.12) и (6.9) могут быть использованы для описания равновесий в реальных системах:
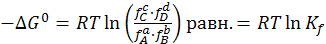 (6.18)
(6.18)
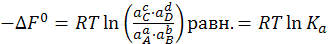 (6.19)
(6.19)
где f – летучести компонентов реакционной смеси,
а – активность компонентов реакционной смеси
 ↑ ↑
летучесть, активность
фугитивность
↑ ↑
летучесть, активность
фугитивность