ЛЕКЦИЯ №8.
Трансплантация зародышей в практике воспроизводства крупного рогатого скота
Трансплантация зародышей – это репродуктивная технология, при которой зародыши, полученные от самки-донора или выращенные в лабораторных условиях (с применением процедуры экстракорпорального оплодотворения, клонирования, трансгеноза и т.д.), переносят в половые пути самки-реципиента для их дальнейшего вынашивания и рождения в срок зрелого плода.
Исторические данные и современное состояние. Первая успешная трансплантация зародышей, приведшая к рождению приплодов, была выполнена на кроликах 27 апреля 1890 г. профессором Кембриджского университета Вальтером Хипом (Walter Heape, 1855…1929); он перенес два 4-клеточных зародыша от чистопородной ангорской крольчихи в верхнюю треть маточной трубы (яйцепровода) самки породы бельгийский чемпион, предварительно спаренной с самцом той же породы. Спустя месяц крольчиха–реципиент родила первых в мире трансплантатов – двух длинношерстных ангорских крольчат, вместе с четырьмя родными - бельгийскими.
Хронология первых успешных пересадок зародышей, полученных естественным путем от домашних и сельскохозяйственных животных
| Год, способ пересадки | Вид животного | Авторы |
| 1934, хирургический | овца | B.L. Warwick, R.O. Berry, W.R. Horlacher |
| 1949, хирургический | коза | B.L. Warwick, R.O. Berry |
| 1950, хирургический | свинья | A.V. Kvasnickii |
| 1951, хирургический | корова | E.L. Willett et al. |
| 1964, нехирургический | корова | L.R. Mutter et. al. |
| 1974, нехирургический | лошадь | N. Oguri, Y. Tsutsumi |
| 1978, хирургический | кошка | M.D. Schriver, D.C. Kraemer |
| 1979, хирургический | собака | G.M. Kinney et al. |
Данные об успешных пересадках зародышей из половых органов донора в половые пути самки-реципиента, обусловивших рождение потомства у домашних и сельскохозяйственных животных, приведены в табл.1:
В нашей стране работы по трансплантации зародышей в 40…50-х гг. прошлого столетия проводили А.И. Лопырин - на овцах, И.И. Соколовская - на кроликах. В 1950 г. на Украине профессору А.В. Квасницкому впервые в мировой практике удалась пересадка зародыша свинье. Первого теленка от хирургической пересадки зародыша получил И.Н. Григорьев в 1977 г., а от нехирургической - Н.И. Сергеев в 1978 г.
В настоящее время трансплантация зародышей практикуется у животных многих видов, но наиболее широко – в молочном и мясном скотоводстве. Коммерческое применение метода в скотоводстве началось в 70-х гг. прошлого столетия.
Для получения преимплантационных зародышей применяются два метода, или программы: «multiple ovulation and embryo transfer (MO&ET)» и «in vitro fertilization and embryo transfer (IVF&ET)». В русскоязычном варианте название первого метода звучит как «множественная овуляция и перенос эмбрионов (МО и ПЭ)», второго – как «экстракорпоральное оплодотворение и перенос эмбрионов (ЭКО и ПЭ) в полость матки».
Трансплантация зародышей крупного рогатого скота по программе МО и ПЭ. Интракорпоральное осеменение и оплодотворение с индукцией суперовуляции – основной способ получения преимплантационных эмбрионов крупного рогатого скота. Ежегодно в мире в молочном и мясном скотоводстве по программе МО и ПЭ от высокопродуктивных коров-доноров получают свыше 750 тыс преимплантационных зародышей (R.J. Mapletoft, 2013). Лидером по производству нативных преимплантационных эмбрионов является Северная Америка (США и Канада).
Работу проводят в следующем порядке: отбор доноров и реципиентов; индукция суперовуляции и осеменение коров в индуцированный половой цикл; оценка реакции яичников на экзогенную гонадотропную стимуляцию и получение зародышей от доноров; оценка, культивирование, определение пола и хранение зародышей; синхронизация полового цикла реципиента с половым циклом донора; пересадка зародышей реципиентам (рис. 1).
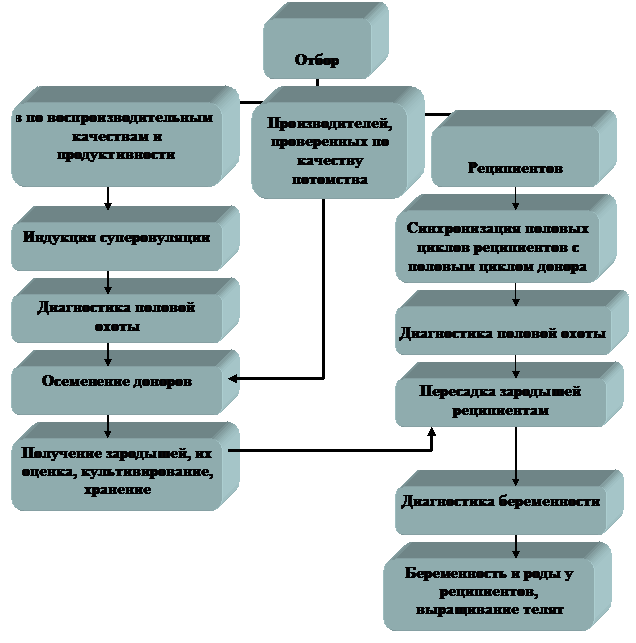
Рис. 1 Схема получения и пересадки зародышей крупного рогатого скота по программе МО и ПЭ
Стимуляция суперовуляции у доноров. Последние десятилетия отмечены большими достижениями в выяснении нейроэндокринных механизмов регуляции процесса репродукции. Расшифрованы основные закономерности процессов роста антральных фолликулов, овуляции, развития и функционирования желтого тела полового цикла и беременности, охарактеризованы особенности гонадотропной регуляции этих процессов (рис. 2).
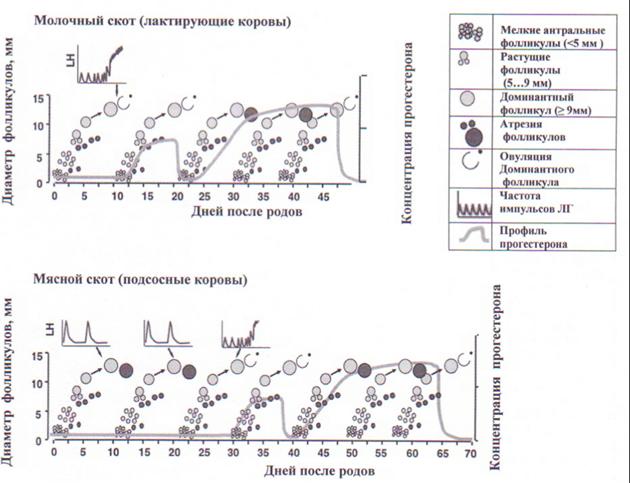
Рис. 2. Особенности фолликулогенеза и возобновления циклической овариальной активности у молочных и мясных коров после отела (M.A. Crowe, 2008)
Динамические эхографические наблюдения за параметрами фолликулогенеза показали, что рост и развитие антральных фолликулов как у половозрелых, так и неполовозрелых самок крупного рогатого скота имеют циклический характер и происходят волнообразно. В течение каждой волны фолликулярного роста из когорты начавших активно расти множества мелких антральных фолликулов, размером 3…5 мм, формируется только один, максимум два доминантных фолликулов.
У циклирующих половозрелых телок и полновозрастных небеременных коров смена одного доминантного фолликула на другой происходит в среднем через каждые 8,5 дня с колебаниями от 6 до 14 дней [S.A. Hamilton et al., 1995]. В течение одного цикла, как правило, регистрируются две или три волны фолликулярного роста (с колебаниями от одной до четырех). Доминантные фолликулы, образующиеся в начале и середине лютеиновой фазы полового цикла, не способны при активно функционирующем желтом теле достигнуть овуляторной стадии зрелости и поэтому подвергаются обратному развитию. При спонтанной (или индуцированной с помощью препаратов ПгФ-2 альфа) регрессии желтого тела полового цикла доминантный фолликул последней волны роста вступает в финальную стадию развития, созревает и овулирует.
После родов у новотельных коров достаточно быстро восстанавливаются запасы гонадотропинов (ФСГ и ЛГ) в передней доле гипофиза и возобновляется циклический рост антральных фолликулов. Первый доминантный фолликул образуется уже на 8…10-й день после отела; он может овулировать с образованием желтого тела, трансформироваться в кисту яичника либо, не достигнув стадии овуляторной зрелости, подвергнуться атрезии и запустить новую овуляторную или ановуляторную волну роста фолликулов. Первый овуляторный половой цикл молочные коровы проявляют в среднем на 18…21-е сут, мясные подсосные коровы – только через 50…100 сут после отела.
Гормональную (искусственную) стимуляцию донора начинают через 2...З мес после отела, убедившись в оптимизации его половых циклов.
В ветеринарной практике для экзогенной стимуляции гонад и индукции суперовуляции в основном применяют естественные препараты фолликулостимулирующего гормона (FSH-P, ФСГ-супер и др.), которые получают из гипофизов убойного скота.
Препараты фолликулостимулирующего гормона имеют короткий период полураспада и по этой причине их вводят многократно внутримышечно (в/м) или подкожно (п/к). Для индукции суперовуляции препарат ФСГ-Г (FSH-P, Shering-Plough, US) применяют по одной из следующих схем: а) по 5 мг ФСГ в/м или п/к 2 раза в день с 10-го по 13-й день полового цикла. За курс вводят суммарно 40 мг ФСГ. Осеменяют в фиксированное время трехкратно каждые 12 ч. Первое осеменение проводят через 24 ч после введения последней дозы ФСГ-Г; б) ФСГ-Г вводят в/м каждые 12 ч с 10-го по 13-й дни полового цикла в дозе: на 10-й день - по 5 мг утром и вечером, на 11-й день – по 4 мг утром и вечером, на 12-й день - по 3 мг утром и вечером, на 13-й день – по 2 мг утром и вечером. За курс вводят 28 мг ФСГ. Осеменяют в фиксированное время трехкратно: первый раз - через 24 ч после введения последней дозы ФСГ, второй и третий раз - с интервалом в 12 ч (Mapletoff, 1986).При применении ФСГ– СУПЕР (Агробиомед, Россия) экзогенную гонадотропную стимуляцию гонад коров-доноров рекомендуется проводить, начиная с 9…10-го дня полового цикла. Препарат вводят внутримышечно в дозе 6 ед. по Арморовскому стандарту (120 МЕ) каждые 12 ч. На третьи сутки одновременно с ФСГ-СУПЕР утром и вечером вводят лютеолитическую дозу простагландина Ф-2 альфа или его синтетического аналога. Через 36…48 ч после инъекции отбирают коров с признаками половой охоты для осеменения. Осеменяют искусственно трехкратно через каждые 12 ч. Зародышей у коров-доноров извлекают в сроки, необходимые для получения преимплантационных эмбрионов желаемых стадий, считая нулевым днем - день первого осеменения животных.
После стимуляции у доноров может образовываться по 10...20 и более яйцеклеток, из которых оплодотворяются 50...80 %.
Синхронизация охоты у доноров и реципиентов. Синхронизация охоты у доноров и реципиентов активизирует функцию яичников, выравнивает стадии полового цикла, что позволяет планировать работу по пересадке зародышей без криоконсервации (замораживания). В практике пользуются различными схемами применения гормональных препаратов и других биологически активных веществ. Но чаще всего для синхронизации состояния охоты используют ПГФ-2 альфа: двукратно, через 10... 12 сут. Одновременно с ПГФ-2α вводят 500 мкг эстрадиола-бензоата. Эффективность метода превышает 90 %.
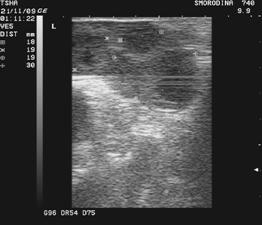
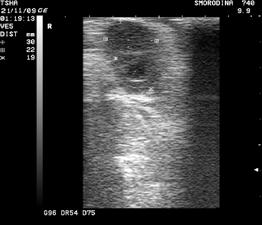
Рис. 3. Пример положительного овариального ответа на экзогенную гонадотропную стимуляцию фоллигоном: в левом яичнике визуализируют четыре, в правом– два желтых тела
Получение зародышей от коров-доноров. Зародышей вымывают из матки коровы-донора нехирургическим способом, обычно утром, после доения. Корову заводят в станок, дают ей хороший корм и выдерживают в течение 40...60 мин. С использованием трансректальной пальпации или УЗИ оценивают реакцию яичников на проведенную экзогенную гонадотропную стимуляцию фолликулогенеза и овуляцию. Маркерами произошедшей овуляции служат желтые тела (рис. 3).
При необходимости вводят корове внутримышечно 0,5...0,7 мл ромпуна или 1,0 мл комбелена. Применяют также сакральную анестезию для расслабления шейки матки и исключения дискомфорта и боли у донора, а также удобства работы. Затем приступают к вымыванию зародышей.
| 
|
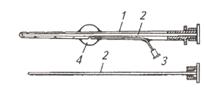
| Рис. 4. Катетер Фоли для извлечения зародышей:1 – корпус; 2 - мандрен (стилет); 3 - воздухоно-сный канал с пробкой; 4 - надувной баллончик | Рис. 5. Извлечение зародышей нехирургическим способом:1- катетер для извлечения зародышей; 2 - шейка матки; 3 - рог матки; 4 - надувной баллончик; 5 - яичники |
Теплым 0,1%-м раствором этакридина лактата (риванола) обмывают наружные половые органы и просушивают чистым полотенцем, ватой. Увлажненной рукой в перчатке пальпируют через прямую кишку матку и яичники, уточняя их состояние, число овулировавших фолликулов и наличие желтых тел. После этого вводят катетер Фоли (марки ИМИ или ОИ-1)со вставленным в него стилетом (рис. 4, 5), продвигая его до верхушки рога под контролем руки. Стилет извлекают, оставляя в прежнем положении конец катетера. Через воздухоносный канал накачивают воздух (15...20 см3) в специальный круглый резиновый баллончик, который фиксирует катетер в роге матки и перекрывает верхушку рога с зародышем.
Предварительно готовят специальные среды, близкие по составу к секрету матки. Лучшей считают среду Дюльбекко, со следующими компонентами: 1) NaCl 8 г/л (136,87 ммоль); 2) КС1 0,2 г/л (2,68 ммоль); 3) Na2HP04 2,9 г/л (8,09 ммоль); 4) KH2I2P04 0,2 г/л (1,47ммоль); 5)СаС12·2Н20 0,13г/л (0,9ммоль); 6) Mg2CI·6H20 0,1 г/л (0,49 ммоль). Среду готовят на тридистиллированной воде. Первые 4 компонента растворяют в 800 мл воды, а 5-й и 6-й — по отдельности в 100 мл. Растворы автоклавируют и смешивают. Их можно хранить при 4°C до 2 нед. Перед употреблением вводят добавки и подогревают до 37,5...38 °C.
Некоторые авторы рекомендуют добавлять 1 % эмбриональной сыворотки или 4 мг/мл бычьего сывороточного альбумина, 0,05 мг/мл дигидрострептомицина сульфата и 100 ИЕ пенициллина. Можно также добавить на 1 л среды Дюльбекко перед использованием 4,0 г бычьего альбумина, 1,0 г глюкозы, 0,036 г натрия пирувата и 100 ИЕ калиевой соли пенициллина. Осмотическое давление растворов должно составлять 300 миллиосмоль, рН 7,2...7,6.
Среду Дюльбекко порциями по 30...50 мл подают из шприца Жанэ через главный канал катетера к верхушке рога (предварительно извлекают мандрен). Жидкость с зародышами отсасывают шприцем в специальный сосуд. Число вымываний 8...12 — до полного извлечения всех зародышей. При соответствующих навыках можно уже с первой порцией раствора (50 мл) вымыть до 60 % зародышей, а на всю процедуру (5...6 вымываний) затратить 250 мл.
Полученную жидкость фильтруют спустя 30 мин через специальный фильтр с отверстиями 7,5·10-2 мм. Можно также пипеткой из цилиндра, удалив верхний слой жидкости, оставшуюся ее часть разлить небольшими порциями в чашки Петри. Отыскав зародышей с помощью лупы, извлекают их и помещают в специальный небольшой сосуд. Современная методика предусматривает получение зародышей из фильтра, вставляемого в сосуд на определенном уровне, на котором и оседают вымытые зародыши.
Оценка качества зародышей. Зародышей оценивают под инверсионным микроскопом в баллах с помощью специальной таблицы (шкала оценки качества зародышей, табл. 2.) и в сравнении с рисунком (рис. 6): полноценные - 5 баллов; с незначительными дефектами - 4; замедленные (ретардированные) - 3; неполноценные - 2 и 1.
Наиболее пригодны для пересадки и замораживания 7-сут зародыши коров на разных стадиях развития.
Шкала оценки качества зародышей
| Стадия развития | Морфологическая характеристика | Оценка | Балл |
| Морула ранняя (МО-1) | Шаровидная форма, прозрачная оболочка, целая; перивителлиновое пространство прозрачное, бластомеры четкие, одинаковых размеров, с наличием полигональной связи, цитоплазма мелкозернистая, равномерно заполняет цитоплазматическую оболочку | Отлично | |
| Морула поздняя (МО-2) | В перивителлиновом пространстве гранулы, включения, бластомеры разных размеров, расположены несимметрично, несколько сжаты | Хорошо | |
| В перивителлиновом пространстве гранулы, включения, незначительное сжатие бластомеров, единичное разрушение | Удовлетво-рительно | ||
| Деформация прозрачной оболочки, частичное разрушение бластомеров, нарушение связи между ними, фрагментация цитоплазмы, сжатые бластомеры | Условно годные | ||
| Несоответствие стадии развития возрасту зародыша, дефекты прозрачной оболочки (трещины, сколы), распад бластомеров, их сильное сжатие | Непригод-ные | ||
| Бластула (БЛ-1) | Шаровидная форма, перивителлиновое пространство узкое, прозрачное, клетки трофобласта и эмбриобласта четко дифференцированы, хорошо различима полость бластулы | Отлично | |
| Бластула поздняя (БЛ-2) | Зона пеллюцида утончена, перивителлиновое пространство отсутствует, полость бластулы большая, с гладкой поверхностью и четкой дифференциацией клеток. В перивителлиновом пространстве полость бластулы не видна, гранулы, включения, клетки трофобласта сжаты незначительно | Хорошо | |
| Перивителлиновое пространство увеличено, имеет включения, гранулы, полость бластулы не выражена, нет дифференциации между клетками трофо- и эмбриобласта | Удовлетво-рительно | ||
| Дефект прозрачной оболочки (трещины, наличие гранул), в перивителлиновом пространстве частичные разрушения клеток, сжатие бластомеров | Условно годные | ||
| Значительный дефект прозрачной оболочки, распад бластомеров | Непригод-ные |
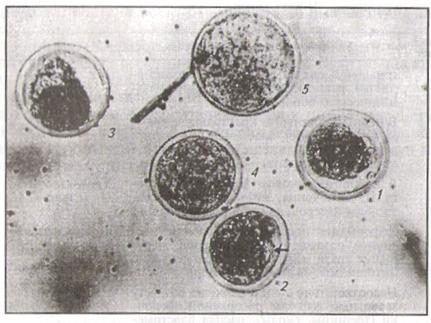
Рис. 6. Зародыши разного качества (в баллах); пояснения даны в тексте
Хранение зародышей. Для кратковременного хранения в течение 1…5 ч используют среду Дюльбекко, в которую добавляют 100 ЕД пенициллина на 1 мл и 4 мг/мл 20%-й сыворотки крови теленка или альбумина бычьей сыворотки. Зародышей помещают на часовое стекло с 0,5 мл питательной среды, переносят в чашку Петри, дно которой покрыто увлажненной фильтровальной бумагой, и хранят в термостате при температуре 37 °С.
Зародышей выдерживают в растворах глицерина в порядке повышения их концентрации: 0,46 М (3,3%), 0,92 М (6%), 1,4 М (10%).
При замораживании зародышей первым методом - в ЗЭМ (замораживатель эмбрионовмобильный Харьковского СКТБ с ОП ИПКнК) - используют специальные контейнеры: стеклянные пробирки длиной 50 мм и диаметром 5 мм, стеклянные ампулы на 1мл, пластиковые соломинки длиной 130 мм и диаметром 2 мм. В каждой пробирке (ампуле) может находиться до 4 зародышей от одного донора в 0,3...0,4 мл среды с криопротектором. Пайетты заправляют с помощью шприца на 1мл с резиновым или пластиковым переходником в следующем порядке: среда — 2/5 объема пайетты, пузырек воздуха — 5 мм, зародыш в среде — 1/5 объема пайетты, воздух —5 мм и среда — 2/5 объема пайетты.
Замораживают по программе с автоматическим сидингом: 1-й этап - стабилизация при температуре 20 °С без ограничения времени; 2-й - охлаждение со скоростью 10С/мин от +20 °С до -7 °С; 3-й - стабилизация при -7 °С в течение 2 мин; 4-й - охлаждение со скоростью 0,30 С/мин от -7 °С
до -32 °С; 5-й — стабилизация при -32 °С в течение 30 мин; 6-й (последний) этап - помещение зародышей, замороженных в пайеттах, в хранилище с жидким азотом (Ф. И. Осташко и др.).
Второй метод — замораживание зародышей с эквилибрацией. Зародыша выдерживают в течение 10 мин в 1,4 М растворе глицерина, затем переносят в 0,9 М раствор на 60...90 мин, после чего помещают в пайетту: раствор № 2 — воздушный пузырек — раствор № 2 с зародышем в середине пайетты — воздушный пузырек — пробка. Пайетту с зародышем в растворе №2 погружают в жидкий азот пробкой вверх до прекращения кипения, а затем переносят в канистры и хранят до использования.
Размораживание зародышей. Размораживают на водяной бане при 370 С в течение 3...5 с. При переносе пайетты из жидкого азота в водяную баню пробку из пайетты извлекают. Зародыша помещают в 0,5 М раствор сахарозы (к 1,7 части сахарозы добавляют 10 мл среды Дюльбекко с 20 % ФБС - фетальной бычей сывортокой). После насыщения сахарозой зародыша отмывают в среде Дюльбекко, содержащей 20 % ФБС. Используют 4 чашки Петри; отмывают путем последовательного переноса с экспозицией по 5 мин.
При трансплантации зародышей на фермах используют одноэтапный метод удаления криопротектора. В этом случае при замораживании компоненты размещают в пайетте таким образом: раствор сахарозы — 0,25 мл или 0,5 мл (2/5 объема), воздух — не более 5 мм, зародыш в ФБС с содержанием 1,0 М или 1,4 М раствора глицерина — 1/5 объема, воздух— 5 мм, раствор сахарозы — 0,25 М или 0,5 М (2/5 объема).
Пересадка (подсадка) зародышей. Реципиента фиксируют в станке, дают хорошего качества мягкое луговое или злаково-бобовое сено, выжидают 30…40 мин для того, чтобы животное успокоилось, затем вводят руку в прямую кишку и освобождают ее от каловых масс.
| 
|
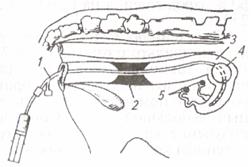
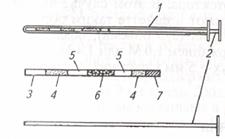
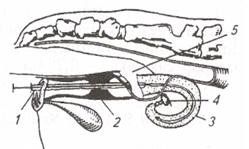
| Рис. 7. Катетер для подсадки зародышей: 1 - металлическая трубка; 2 -стилет; 3 – соломинка (пайетта); 4 – среда; 5 – воздух; 6 – среда с зародышем; 7 – фильтр-пыж | Рис. 8. Техника подсадки зародышей реципиентам:1 – прибор для введения зародыша; 2 - шейка матки; 3 — рог матки; 4 – яичник; 5 – рука, введенная в прямую кишку |
Наружные половые органы обмывают теплой водой с мылом, дезинфицируют раствором фурацилина 1:5000, после чего вытирают сухой стерильной салфеткой. Производят сакральную анестезию 2 %-м раствором новокаина (5 мл). Берут пайетту с преимплантационным эмбрионом и стерильными ножницами отрезают с одного ее конца фильтр-пыж. Пайетту устанавливают в шприц-катетер таким образом, чтобы отрезанный край пайетты был впереди, а фильтр-пыж с заднего конца будет служить поршнем для выталкивания эмбриона мандреном (стилетом). Катетер заключают в защитный кожух (санитарный чехол) и вводят по верхней стенке влагалища до шейки матки; санитарный чехол прорывают и катетер продвигают через канал шейки к верхушке рога, затем нажатием на стилет катетера зародыша вводят в рог матки, а сам катетер извлекают (рис. 7, 8).
Наступление беременности контролируют ректальным исследованием через 2...2,5 мес либо методом трансректальной визуальной эхографии – через 4 нед после подсадки зародыша.
Частота наступления беременности после трансплантации свежеполученных эмбрионов достигает 48…73%, замороженно-оттаяных - 36…63 % (Hasler, 2001).
Трансплантация зародышей крупного рогатого скота по программе ЭКО и ПЭ. Возможность оплодотворения яйцеклеток млекопитающих в условиях in vitro была впервые показана в 1934 г. советским исследователем О.В. Красовской. Практическое применение данный метод получил только в конце XX – начале XXI-го века (табл. 3).