ВВЕДЕНИЕ
Важной особенностью заболеваний, обусловленных патологией системы гемостаза, является то, что без надежной лабораторной базы выявление их истоков невозможно, поскольку клинические проявления этих широко распространенных нарушений зачастую схожи, что не позволяет применить эффективные и патогенетически обоснованные методы их коррекции.
ОСНОВЫФУНКЦИОНИРОВАНИЯ СИСТЕМЫГЕМОСТАЗА
Термином «гемостаз» принято обозначать важнейший защитный механизм организма, основными задачами которого являются поддержание жидкого состояния текущей в неповрежденных сосудах крови, предупреждение кровопотери путем остановки кровотечения и поддержания замкнутости сосудистого русла в случае его повреждения, и восстановление проходимости кровеносных сосудов после их тромбирования. Система гемостаза, обладая практически полной автономией, позволяет полноценно осуществлять специфические функции без дополнительного вовлечения многих других систем организма, поддерживающих гомеостаз, что с точки зрения жизнеобеспечения организма в экстремальных ситуациях весьма целесообразно.
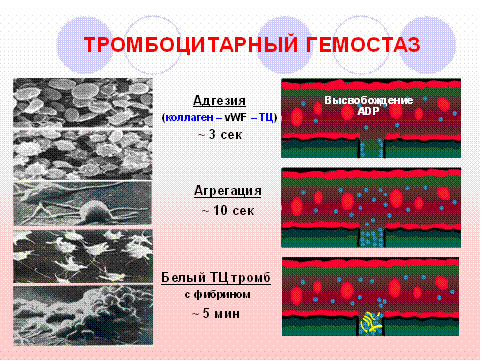
Ведущая роль в остановке кровотечений в зоне микроциркуляции (проксимальных и терминальных артериол, метартериол, прекапилляров, капилляров и венул) принадлежит сосудам в месте повреждения и тромбоцитам, поэтому большинством авторов эти структуры и физиологические реакции, направленные на остановку кровотечения из мелких сосудов и капилляров, объединяются термином «сосудисто-тромбоцитарный гемостаз».
Основные функции свертывающей системы крови: поддержание жидкого состояния крови и быстрое купирование повреждения сосудистой стенки. В процессе принимают участие клетки крови, эндотелий сосудов и циркулирующие в крови белки – факторы свертывания крови. Первыми в ответ на повреждение реагируют кровеносные сосуды и клетки. На следующем этапе включаются плазменные ферментные системы, лавинообразно активирующие друг друга и обеспечивающие образование фибринового сгустка и последующий его лизис. Противосвертывающая система антитромбина III, протеина С, и ряда других белков проводит тонкое регулирование механизма свертывания и фибринолиза.

Согласно современным представлениям, физиологические реакции этого звена гемостаза протекают в определенной последовательности. В ответ на повреждение микрососудов возникает их локальный рефлекторный спазм, который поддерживается и продлевается вазоактивными веществами (адреналином, норадреналином, серотонином и др.), попадающими в место повреждения из стенок травмированных сосудов, эритроцитов и тромбоцитов. После контакта тромбоцитов с обнажившимся коллагеном субэндотелия происходит их активация. Агрегация тромбоцитов значительно усиливается при появлении тромбина и АДФ в зоне повреждения. Реакции агглютинации и агрегации являются основой формирования так называемой тромбоцитарной пробки, которая эффективно препятствует кровотечению из мелких сосудов.
В более крупных сосудах надежный гемостаз обеспечивается коагуляционным механизмом (коагуляционный или плазменный гемостаз).
В результате многочисленных исследований на моделях клеток было установлено, что коагуляционные реакции протекают поэтапно. В норме большинство протеинов, участвующих в коагуляции, являются проферментами, а процесс свертывания крови – это цепь последовательных биохимических реакций, в которой проферменты, активируясь, приобретают способность активировать другие факторы свертывания крови. В этой цепи можно условно выделить два пути инициации коагуляции: внешний (основной) и внутренний (рис.1).
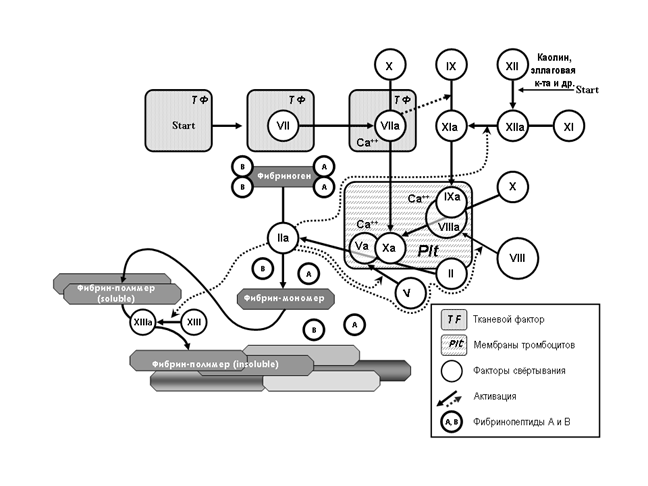
Рисунок 1. Последовательность коагуляционных реакций.
Запуск реакций коагуляции по внешнему пути начинается с появления тканевого фактора в просвете сосуда и формирования комплекса TF/VIIа, который активирует факторы X и IX. Далее фактор Xa трансформирует протромбин в тромбин. Фактор V, активируемый тромбином в форму Vа, значительно ускоряет образование тромбина на фосфолипидных мембранах.
Внутренний механизм свертывания крови начинается с активации фактора Хагемана (ф.XII) коллагеном из эндотелия. В физиологических условиях роль фактора XII в гемостазе незначительна (в большей степени служит для активации фибринолиза). В лабораторном тестировании гемостаза роль фактора XII, напротив, велика: он активируется каолином, эллаговой кислотой, солями кремния и др., а затем преобразует фактор XI в XIа. Важнейшим продуктом последовательных биохимических реакций коагуляции является тромбин (фактор IIa). От фибриногена этот фермент отщепляет 2 фибринопептида А и 2 фибринопептида В, и молекула фибриногена после их отделения (дез-АВ-фибрин-мономер) приобретает способность полимеризоваться, т.е. соединяться с себе подобными. В процессе полимеризации образуются димеры, тримеры и олигомеры фибрина, а затем фибриллы растворимого фибрина (Soluble fibrin). Активированный тромбином фибрин-стабилизирующий фактор (ф.XIIIa) в присутствии ионов Ca2+ превращает растворимый фибрин в стабильный нерастворимый фибрин (Insoluble fibrin). Последующая ретракция кровяного сгустка ведет к образованию стабильного, непроницаемого и плотного тромба, что значимо уменьшает или вовсе прекращает кровопотерю вследствие травмы тканей. Физиологические антикоагулянты (антитромбин, протеины С и S, ингибитор пути тканевого фактора – TFPI, кофактор гепарина II и др.) предупреждают генерализацию (распространение из зоны повреждения сосуда) процессов тромбообразования.
Основной физиологической задачей фибринолиза является восстановление кровотока в сосуде после формирования в нем тромба. Ферментная фибринолитическая система также контролирует заживление ран и ряд других важнейших функций организма. Основным компонентом этой системы является одноцепочечный гликопротеин, состоящий из 791 аминокислоты – плазминоген. Частичный протеолиз его молекулы ведет к образованию плазмина – фермента, способного разрушить сгусток фибрина и восстановить кровоток в сосуде. Принято различать внешний и внутренний пути активации фибринолиза. Внешняя активация идет под действием тканевого активатора плазминогена (t-PA), синтезирующегося в эндотелиальных клетках, а также под влиянием урокиназы (u-PA); активации фибринолиза способствует активированный протеин С. Внутренний путь активации фибринолиза может быть инициирован коагуляционным фактором ХIIа при участии калликреина и высокомолекулярного кининогена. В результате лизиса фибрина в крови появляются продукты его деградации (ПДФ), важнейший из них и доступный для лабораторных исследований – D-димер.
Наиболее сильными инактиваторами фибринолитических процессов являются a2-антиплазмин, активируемый тромбином ингибитор фибринолиза (TAFI), а также ингибиторы активатора плазминогена PAI-1 и PAI-2, образование которых усиливается при повреждении эндотелия.
