Задачи для выполнения домашнего задания
для студентов всех форм обучения cпециальностей:
1007 – Промышленная теплоэнергетика;
1016 – Энергообеспечение предприятий
Екатеринбург 2001
УДК 662.767: 697.3 (031)
Составители В.А. Мунц, С.Б. Путрик
Научный редактор проф., д-р техн. наук А.М. Дубинин
ТОПЛИВО И ТЕОРИЯ ГОРЕНИЯ: Задачи для выполнения домашнего задания / В.А. Мунц, С.Б. Путрик. Екатеринбург: УГТУ-УПИ, 2001. 18 с.
Приведены расчетные выражения и основные соотношения по курсу «Топливо и теория горения». Даны варианты домашних заданий по различным разделам курса.
Библиогр.: 8 назв. Табл. 2.
Подготовлено кафедрой «Промышленная теплоэнергетика».
Ó Уральский государственный
технический университет - УПИ, 2001
В условиях задач в качестве параметра задан номер варианта, который присваивают студенту перед выдачей задания.
Тема: ТОПЛИВО
Элементный состав твердого и жидкого топлива
Рабочее состояние – это состояние, в котором топливо поступает на сжигание:
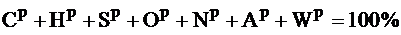 .
.
Аналитическое состояние топлива – это состояние топлива, подготовленное для проведения анализа:

 .
.
Сухое состояние топлива – без влаги:
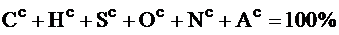 .
.
Условное сухое беззольное состояние топлива (горючее) – без влаги и минеральных примесей:
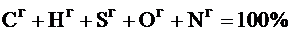 .
.
Органическое состояние топлива – без колчеданной серы:

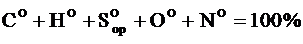 .
.
Таблица 1
Коэффициенты пересчета из одного состояния в другое
| Заданное состояние топлива | Искомое состояние топлива | ||
| рабочее | сухое | условное сухое беззольное | |
| Рабочее | 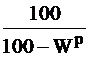
| 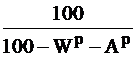
| |
| Сухое | 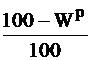
| 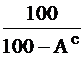
| |
| Условное сухое беззольное (горючее) | 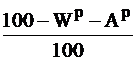
| 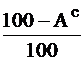
|
Теплота сгорания твердого и жидкого топлива, кДж/кг:
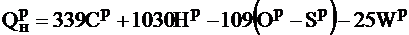 .
.
Теплота сгорания газообразного топлива, МДж/м3:
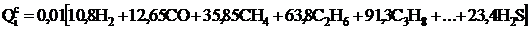 . Изменение теплоты сгорания твердого топлива при изменении его влажности от
. Изменение теплоты сгорания твердого топлива при изменении его влажности от 
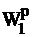 до
до 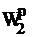 может быть рассчитано по выражению, кДж/кг:
может быть рассчитано по выражению, кДж/кг:
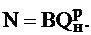 |

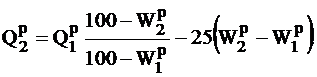
Тепловая мощность топочного устройства связана с расходом B топлива и теплотой сгорания соотношением
Задача № 1
Определить состав топлива в рабочем состоянии, если в таблицах свойств топлив указан следующий состав: С1р=38,6%; Н1р=2,6%; S1р=3,8%; N1р=0,8%; О1р=3,1%; W1р=11+№/2 %; А1р– остальное. А технический анализ показал, что действительная влажность топлива составляет W2р=16+№/2 %. Определить состав топлива при действительной влажности и его теплоту сгорания.
Задача № 2
Определить элементный состав топлива в рабочем состоянии, если задано условное сухое беззольное (горючее) состояние Сг=85%; Hг=6%; Sг=4%; Oг=4%; Nг=1%, и известно, что влажность в рабочем состоянии составляет Wр=18,6+№/2 %, а зольность в сухом состоянии топлива Ас=10+№/2 %. Определить теплоту сгорания топлива.
Задача № 3
Теплота сгорания топлива Q1р=10+№/2 МДж/кг при влажности W1р=10-№/5 %. Определить теплоту сгорания при влажности W2р=20-№/5 %.
Задача № 4
Задан состав топлива: Сс=50+№/2 %; Нс=№/5 %; Sс=1+№/20 %; Nс=1%; Oс=5+№/20 %; остальное - Aс; Wр=№ %. Определить низшую теплоту сгорания в рабочем состоянии.
Задача № 5
Дан состав газообразного топлива: СН4=50-№ %; СО=10+№/2 %; Н2=10+№/2 %; остальное - N2. Определить теплоту сгорания.
Задача № 6
Задан состав топлива в газообразном состоянии: СН4=50+№ %;
Н2=25-№ /2 %; СО=25-№/2 %. Определить тепловую мощность, если расход топлива равен В=3000+№×10 м3/ч.
Задача № 7
Задан состав твердого топлива: Ср=40 %; Hр=2 %; Sр=Nр=1 %; Oр=№/2 %; Aр=10 %; остальное - Wр - и состав жидкого топлива: Ср=90 %; Hр=6 %; Nр=Oр=Sр=Aр=1 %. Определить мощность топочного устройства, если известно, что расход твердого топлива составляет Вт=2000+№×50 кг/ч, а расход жидкого топлива Вж=№/30 кг/с.
Тема: РАСЧЕТ ТЕОРЕТИЧЕСКИ НЕОБХОДИМОГО КОЛИЧЕСТВА
ВОЗДУХА, ОБЪЕМЫПРОДУКТОВ СГОРАНИЯ, ЭНТАЛЬПИЯ,
КОЭФФИЦИЕНТ ИЗБЫТКА ВОЗДУХА
Теоретически необходимый объем воздуха для окисления 1 кг твердого или жидкого топлива, м3/кг:
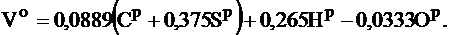
Теоретически необходимый объем воздуха для окисления 1 м3 газообразного топлива, м3/м3:
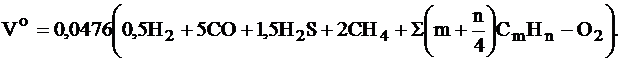 Теоретический объем продуктов сгорания, м3/кг (м3/м3):
Теоретический объем продуктов сгорания, м3/кг (м3/м3):
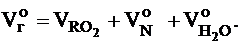
Теоретический объем сухих трехатомных газов:
- при сжигании твердого и жидкого топлива, м3/кг:
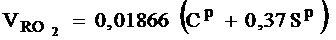 ;
;
- при сжигании газообразного топлива, м3/м3:
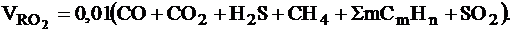
Теоретический объем азота:
- при сжигании твердого и жидкого топлива, м3/кг:
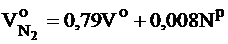 ;
;
- при сжигании газообразного топлива, м3/м3:

Теоретический объем водяных паров:
- при сжигании твердого и жидкого топлива, м3/кг:
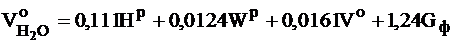 ,
,
где Gф – удельный расход пара на распыл мазута;
- при сжигании газообразного топлива, м3/м3:
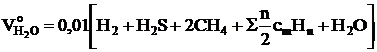 .
.
Действительный объем продуктов сгорания, м3/кг (м3/м3):
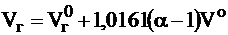 .
.
Объем сухих газов, м3/кг (м3/м3):
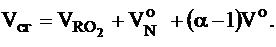
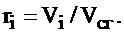 |
Объемная доля какого-либо компонента в сухих продуктах сгорания:
Массовый выброс какого-либо компонента, например диоксида серы, кг/ч:
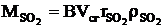 |
Коэффициент избытка воздуха:
- азотная формула:
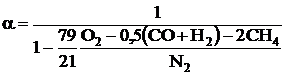 ;
;
- кислородная формула:
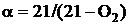 ;
;
- по содержанию сухих трехатомных газов в продуктах сгорания:
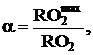
где 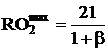 , а
, а 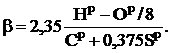
Энтальпия продуктов сгорания, кДж/кг (кДж/ м3):
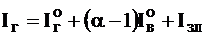 .
.
Энтальпия теоретического количества продуктов сгорания, кДж/кг (кДж/ м3):

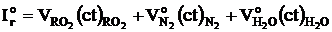 .
.
Энтальпия теоретически необходимого количества воздуха, кДж/кг
(кДж/ м3):
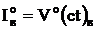 .
.
Энтальпия золы, кДж/кг (кДж/ м3):
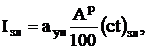
где 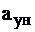 - доля уносимой золы.
- доля уносимой золы.
Задача № 8
Задан состав топлива: Сг=60+№/3 %; Hг=20–№/3 %; Oг=18%; Sг=1%; Nг=1%; Aс=25+№/2 %; Wр=30+№/2 %. Определить V0; Qнр и отноше- ние Qнр/V0.
Задача № 9
Определить тепловую мощность топки и расход воздуха при совместном сжигании мазута и газа с коэффициентом избытка воздуха a=1,1. Расход мазута Вм=8+№/10 кг/с, расход газа Вг=6+№/10 м3/с, состав мазута: Ср=80+№/20 %; Hр=13–№/20 %; Sр=2,9%; Nр=0,3%; Oр=0,1%; Wр=3,4%; Aр=0,3%. Состав газа: СН4=70+№/10 %; СО=3%; С2Н6=1,9%; N2 – остальное.
Задача № 10
Тепловая мощность котла 50 МВт; КПД=85%. В котле сжигают природный газ следующего состава: СН4=85-№/5 %; СО2=3+№/40 %; С2Н6=1+№/40 %; N2 – остальное. Как изменится расход воздуха, если с тем же избытком воздуха a=1,1 и с тем же h сжигать доменный газ следующего состава: СО=25+N/5%; СО2=25-N/5%; N2=35%; Н2=10; СН4=5%?
Задача № 11
Рассчитать объемы и расход продуктов сгорания при сжигании твердого топлива следующего элементного состава: Ср=40+№/2 %; Hр=2+№/10 %; Sр=1 %; Oр=10-№/10 %; Nр=1 %; Wр=28–№/2 %; Aр - остальное. Определить энтальпию продуктов сгорания при t=13000С и избытке воздуха a=1,2. Расход топлива 4 т/ч; теплоемкость продуктов сгорания принять равной сг=1,5 кДж/(м3×К); энтальпией золы пренебречь.
Задача № 12
Рассчитать объемы и расход продуктов сгорания при сжигании газообразного топлива с расходом 10000 м3/ч при избытке воздуха a=1,4. Состав топлива: СН4=42+№/2 %; СО=32-№/2 %; Н2=10 %; Н2S=10+№/10 %; остальное - N2. Определить энтальпию продуктов сгорания при tух=1300С. Теплоемкость продуктов сгорания принять равной сг=1,4 кДж/(м3×К).
Задача № 13
Для условий задачи № 12 определить концентрации газовых компонентов в сухих продуктах сгорания. Рассчитать часовой выброс оксидов серы.
Задача № 14
Состав топлива: Сг=80 %; Hг=20 %; Ар=№/2 %; Wр=№ %. Определить, во сколько раз теоретический объем продуктов сгорания больше объема теоретически необходимого количества воздуха.
Задача № 15
Из результатов химического анализа известно, что содержание газов в продуктах сгорания составляет: О2=5+№/30 %; CO=1 %; H2=2%; CH4=1,75 %; CO2=15+№ /5 %. Определить коэффициент избытка воздуха.
Задача № 16
После проведения химического анализа продуктов сгорания за топкой и конвективной шахтой котла получены следующие данные. За топкой: О2т=4+№/15 %; COт=1,5 %; Н2т=1%; СО2т=15+№/5 %. За конвективной шахтой: О2к=6+№/15 %; СОк=1 %; СО2к=14+№/5 %. Определить присос в конвективную шахту.
Задача № 17
Определить максимально возможное содержание сухих трехатомных газов 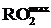 в продуктах сгорания угля следующего состава: Ср=43,4+№/2 %; Hр=4–№/15 %; Oр=7 %; Nр=0,8 %; Sр=0,3 %.
в продуктах сгорания угля следующего состава: Ср=43,4+№/2 %; Hр=4–№/15 %; Oр=7 %; Nр=0,8 %; Sр=0,3 %.
Рассчитать коэффициент избытка воздуха, если измеренная концентрация RO2=10+№/15 %.
Задача № 18
Определить максимально возможное содержание сухих трехатомных газов 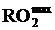 в продуктах сгорания природного газа следующего состава: СН4=92+№/30 %; C2H6=3,2 %; C3H8=0,4 %; C4H10=0,1 %; остальное - N2. Определить коэффициент избытка воздуха, если измеренная концентрация RO2=5+№/15 %.
в продуктах сгорания природного газа следующего состава: СН4=92+№/30 %; C2H6=3,2 %; C3H8=0,4 %; C4H10=0,1 %; остальное - N2. Определить коэффициент избытка воздуха, если измеренная концентрация RO2=5+№/15 %.
Задача № 19
Концентрация кислорода в исходной смеси метан – воздух составляет О2=16+№/15 %. Определить коэффициент избытка воздуха.
Тема: ТЕОРЕТИЧЕСКАЯ ТЕМПЕРАТУРА ГОРЕНИЯ,
ТЕПЛОВОЙ БАЛАНС
Располагаемая теплота, кДж/кг (кДж/ м3):
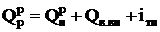 ,
,
где 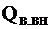 - теплота, вносимая в топку воздухом, подогретым вне котла;
- теплота, вносимая в топку воздухом, подогретым вне котла; 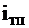 - физическая теплота топлива.
- физическая теплота топлива.
Располагаемая теплота расходуется на производство полезной теплоты 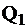 и тепловые потери
и тепловые потери
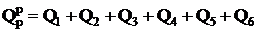 ,
,
или
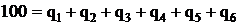 .
.
Наибольшей является потеря теплоты с уходящими газами, %,
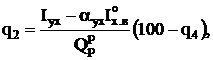
где 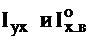 - энтальпия уходящих газов и теоретического количества холодного воздуха (при температуре 30 ºС) соответственно;
- энтальпия уходящих газов и теоретического количества холодного воздуха (при температуре 30 ºС) соответственно; 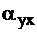 - коэффициент избытка воздуха в уходящих газах.
- коэффициент избытка воздуха в уходящих газах.
Потеря теплоты с химической неполнотой сгорания, %:
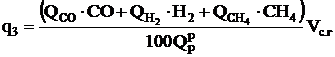 .
.
Потеря теплоты с механической неполнотой сгорания, %:
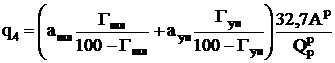 ,
,
где ашл иаун – соответственно доля золы в шлаке и в уносе, Гшл и Гун – содержание горючих в шлаке и уносе, %; 32,7 – теплота сгорания коксовых частиц в шлаке и уносе, кДж/кг.
Потеря теплоты от наружного охлаждения q5 находится в пределах от 0,2 до 2,5%.
Потеря теплоты с физической теплотой шлака, %:
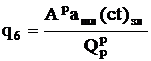 ,
,
где 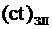 - произведение температуры и теплоемкости шлака.
- произведение температуры и теплоемкости шлака.
Коэффициент полезного действия котла равен, %,
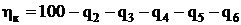 .
.
Полезное тепловосприятие связано с паропроизводительностью 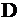 котла соотношением
котла соотношением
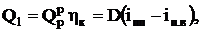
где 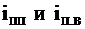 - энтальпия перегретого пара и питательной воды, кДж/кг.
- энтальпия перегретого пара и питательной воды, кДж/кг.
Теоретическая температура горения, °C:
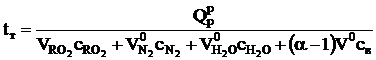 ,
,
где 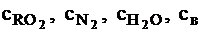 - теплоемкости сухих трехатомных газов, азота, паров воды и воздуха соответственно, кДж/(м3×К), при данной температуре.
- теплоемкости сухих трехатомных газов, азота, паров воды и воздуха соответственно, кДж/(м3×К), при данной температуре.
В диапазоне температур 1200-1600°С в первом приближении можно принять теплоемкость продуктов сгорания равной 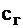 =1,5 кДж/(м3×К), тогда
=1,5 кДж/(м3×К), тогда
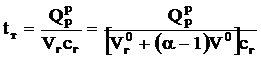 .
.
Задача № 20
Задан состав топлива: Сг=80 %; Hг=10 %; Ог=8 %; Sг=1%; Nг=1%; Aс=10+№/2 %; Wр=20+№/2 %. Определить теоретическую температуру горения при коэффициенте избытка воздуха a=1,3. Топливо и воздух не подогреваются. При расчете принять сВ=1,48 кДж/(м3×К); 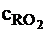 =2,4 кДж/(м3×К);
=2,4 кДж/(м3×К); 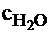 =1,9 кДж/(м3×К);
=1,9 кДж/(м3×К); 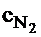 =1,47 кДж/(м3×К); энтальпией золы пренебречь.
=1,47 кДж/(м3×К); энтальпией золы пренебречь.
Задача № 21
Для условий задачи №20 определить, как изменится теоретическая температура горения, если воздух подогревается до температуры tВ=350+№×2 °C.
Задача № 22
Задан состав газообразного топлива (доменный газ): СО=15+№,%; CO2=10%; H2=5+№/10 %; CH4=2+№/10 %; остальное - N2. Определить теоретическую температуру горения при коэффициенте избытка воздуха a=1,3. Топливо и воздух не подогреваются. При расчетах принять cВ=1,48 кДж/(м3×К); 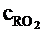 =2,4 кДж/(м3×К);
=2,4 кДж/(м3×К); 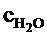 =1,9 кДж/(м3×К);
=1,9 кДж/(м3×К); 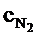 =1,47 кДж/(м3×К).
=1,47 кДж/(м3×К).
Задача № 23
Для условий задачи № 22 определить, как изменится теоретическая температура горения, если воздух подогревается до температуры tВ=350+№×2°С.
Задача № 24
Для условий задачи № 22 рассчитать, какое количество природного газа с содержанием СН4=96 %; С2Н4=2 %; N2=2 % надо подмешать к доменному газу, чтобы теплота сгорания смеси стала равной 20 МДж/м3.
Задача № 25
Определить максимально возможное содержание влаги в топливе, при котором возможно его сжигание в факеле. Состав топлива: Сг=100 %; Ас=20+№ %; коэффициент избытка воздуха a=1,3. Минимальная температура устойчивого горения t=1200+№×3 °C. Теплоемкость продуктов сгорания принять равной сг=1,5 кДж/(м3×К).
Задача № 26
Определить снижение выбросов СО2 при получении 1 МВт тепловой мощности при замене твердого топлива на газообразное. Состав твердого топлива: Сг=80 %; Hг=2 %; Ог=17%; Sг=0,5 %; Nг=0,5 %; Aс=10+№/3 %; Wр=10+№/2%. Состав газообразного топлива: СН4=90+№/10 %; C2H6=2%; C3H8=0,5 %; остаток - N2, КПД сжигания - 82 %.
Задача № 27
Определить количество вырабатываемого пара давлением Р=4 МПа и температурой перегретого пара tпп=440°С (энтальпия перегретого пара iпп=3308 кДж/кг) при сжигании в котле природного газа с расходом В=(8+№/8)103 м3/ч при коэффициенте избытка воздуха в уходящих газах aух=1,4 и температуре tух=160°С. Состав газа: СН4=62+№/2 %; СО= =32-№/2 %; Н2=2 %; остальное - N2. При расчетах принять сг=1,5 кДж/(м3×К); q5=0,8%; q3=0%.
Задача № 28
Определить потери теплоты с механической неполнотой сгорания при сжигании твердого топлива следующего состава: Сг=80 %; Hг=10 %; Ог=8%; Sг=Nг=1 %; Aс=10+№/2 %; Wр=10+№/2 %, если известно, что ашл=0,5; Гшл=27+№/2 %; Гун=31–№/2 %.
Задача № 29
Для условий задачи №27 определить, каков должен быть расход мазута с теплотой сгорания 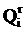 =41 МДж/кг для обеспечения той же паропроизводительности, при сохранении постоянного значения КПД котла.
=41 МДж/кг для обеспечения той же паропроизводительности, при сохранении постоянного значения КПД котла.
Задача № 30
Рассчитать расход воздуха, подаваемого в топку котла для сжигания угля в плотном слое, если известно, что тепловое напряжение зеркала горения топки площадью F=5+№ /5 м2 составляет qF=2+№/30 МВт. Коэффициент избытка воздуха a=1,5.
Тема: КИНЕТИКА ГОРЕНИЯ ГАЗОВЫХ СМЕСЕЙ
Скорость химического реагирования в соответствии с законом действующих масс может быть представлена в виде
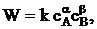
где 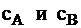 - концентрации исходных веществ, а
- концентрации исходных веществ, а 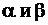 - стехиометрические коэффициенты реакции
- стехиометрические коэффициенты реакции
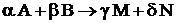 .
.
Константа скорости химического реагирования зависит от температуры по закону Аррениуса
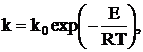
где 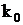 - предэкспоненциальный множитель м/с; Е – энергия активации, кДж/кмоль; R=8,314 кДж/(кмоль×К) – универсальная газовая постоянная; Т –температура, К.
- предэкспоненциальный множитель м/с; Е – энергия активации, кДж/кмоль; R=8,314 кДж/(кмоль×К) – универсальная газовая постоянная; Т –температура, К.
Максимальная скорость реакции достигается в стехиометрической смеси. Концентрация горючего в смеси с окислителем, при которой достигается максимум скорости горения, рассчитывается по уравнению реакции, например при горении метана в смеси с воздухом и азотом
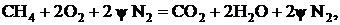
где y - отношение концентраций азота и кислорода в окислителе (для воздуха y=79/21=3,76). Объемная доля метана, при которой достигается максимум скорости реагирования, составит
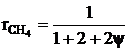 .
.
Скорость нормального распространения пламени 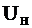 связана с толщиной фронта горения d соотношением
связана с толщиной фронта горения d соотношением
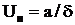 ,
,
где а – коэффициент температуропроводности, м2/с.
Длина факела диффузионной горелки L рассчитывается по выражению
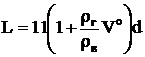 ,
,
где d – диаметр устья горелок; rГ и rВ – плотности газа и воздуха, кг/м3.
Время горения одиночной капли жидкого топлива, с,
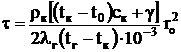 ,
,
где  rк – плотность жидкого топлива, кг/м3; сК – теплоемкость жидкого топлива, кДж/(кг×К); g - теплота испарения жидкого топлива, кДж/кг; lГ – теплопроводность газа, Вт/(м×К); r0 – начальный радиус капли жидкого топлива, м; t0 и tК – начальная температура капли и температура кипения жидкого топлива, °С; tГ – температура газов, °С.
rк – плотность жидкого топлива, кг/м3; сК – теплоемкость жидкого топлива, кДж/(кг×К); g - теплота испарения жидкого топлива, кДж/кг; lГ – теплопроводность газа, Вт/(м×К); r0 – начальный радиус капли жидкого топлива, м; t0 и tК – начальная температура капли и температура кипения жидкого топлива, °С; tГ – температура газов, °С.
Задача № 31
Определить энергию активации и предэкспоненциальный множитель, если известно, что при t1=700+№·10°С константа скорости реакции равна k1=4,4·103 1/с, а при температуре t2=900+№·10 0С константа скорости k2=7,2·103 1/с. Построить зависимость ln(k)=f(1/T).
Задача № 32
Определить нормальную скорость распространения пламени, если в эксперименте на цилиндрической горелке радиусом 15 мм получено конусное пламя с высотой конуса h=25 мм. В горелку подавался водород с расходом 3+№/10 м3/с, который перед горелкой смешивали с воздухом. Коэффициент избытка воздуха равен a =1,1+0,01·№.
Задача № 33
Определить концентрацию метана в смеси с окислителем, состоящим из кислорода и азота, при которой скорость реакции СН4+О2 будет максимальна. Доля азота в смеси с кислородом составляет y=2,5+№/30.
Задача № 34
Определить концентрацию водорода в смеси с окислителем, состоящим из кислорода и азота, при которой скорость реакции Н2+О2 будет максимальна. Доля азота в смеси с кислородом составляет y=4-№/20.
Задача № 35
Диаметр горелки D1=0,01 м, скорость проскока пламени в неё w=0,5+№/30 м/с. Как изменится скорость проскока пламени при использовании горелки с диаметром D2=100 мм?
Задача № 36
Известно, что скорость распространения пламени в смеси кислород- водород составляет Uн=13+№/15 м/с. Какова будет толщина фронта пламени, если значение коэффициента температуропроводности составляет а=2·10-3 м2/с?
Задача № 37
Рассчитать длину факела диффузионной горелки при ее тепловой мощности, равной N=2,5+№/5 МВт. Состав газообразного топлива: СО=15+№ %; CO2=10%; H2=5+№/10 %; CH4=2+№/10 %; остальное - N2. Принять скорость истечения газа равной 50 м/с.
Задача № 38
Рассчитать полное время выгорания капли жидкого топлива начальным размером d=1·10-4·№ м и начальной температурой t0=10°С. Температура газов tг=1500°С, избыток воздуха a=1,05, l г=4·10-2 Вт/(м×К). Теплофизические свойства: теплоемкость топлива сК=2,5 кДж/кг; теплота испарения топлива γ=1700 кДж/кг; температура кипения капли tК=360 °С; плотность топлива rК=900 кг/м3.
Тема: ГОРЕНИЕ УГЛЕРОДА
Удельный поток углерода, кг/(м2·с):
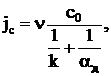
где с0 – концентрация кислорода на бесконечном удалении от одиночной частицы углерода, кг/м3; ν=0,375 – стехиометрический коэффициент; k – константа скорости химического реагирования, м/с; aд – коэффициент реакционного газообмена, м/с, рассчитываемый по формуле
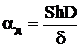 ,
,
где Sh – критерий Шервуда (для неподвижной одиночной частицы равен двум); d - диаметр сферической коксовой частицы, м; D – коэффициент молекулярной диффузии, м2/с.
Для процессов горения D принимается как коэффициент взаимодиффузии кислорода и азота:
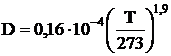 .
.
Константа скорости химического реагирования рассчитывается по уравнению Аррениуса 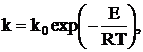 где Е - энергия активации для разных топлив (табл.2).
где Е - энергия активации для разных топлив (табл.2).
Таблица 2.
Значения энергии активации для различных видов топлива
| Энергия активациии | Вид топлива | ||
| бурый уголь | каменный уголь | антрацит | |
| Е, кДж/кмоль | 90 000 | 110 000 | 140 000 |
Предэкспоненциальный множитель ko находят из уравнения
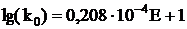 .
.
При известном содержании кислорода О2 в газе, выраженного в процентах, массовая его концентрация определяется по выражению, кг/м3:
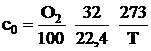 .
.
Концентрация кислорода на поверхности коксовой частицы, кг/м3:

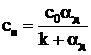 .
.
Высота слоя топлива, обеспечивающая сжигание с заданным избытком воздуха, м:
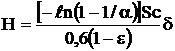 ,
,
где Sс=0,7-0,74 – критерий Шмидта; a-коэффициент избытка воздуха; e=0,44-0,52 – порозность слоя; d - средний диаметр частиц топлива, м.
Задача № 39
Рассчитать константу химического реагирования и коэффициент реакционного газообмена при сжигании частицы бурого угля при температуре t=1300+№·10 °С для диаметров: а) d=1+№/10 мм; б) d=10+№/10 мкм.
Задача № 40
Для условий задачи № 39 определить область реагирования частиц топлива и рассчитать концентрацию кислорода на поверхности частицы.
Задача № 41
Для условий задачи № 39 рассчитать полное время выгорания частицы топлива.
Задача № 42
Рассчитать высоту плотного слоя при сжигании частиц антрацита средним диаметром d=25+№/10 мм; избыток воздуха a=1,4; критерий Шмидта Sh=0,74.
Список литературы
1. Хзмалян Д.М., Каган Я.А. Теория горения и топочные устройства. М.: Энергия, 1976. 488 с.
2. Померанцев В.В. Основы практической теории горения. Л.: Энергия, 1973. 264 с.
3. Померанцев В.В. Сборник задач по теории горения. Л.: Энергоатомиздат, 1983. 152 с.
4. Хзмалян Д.М. Теория топочных процессов: Учебное пособие для вузов. М.: Энергоатомиздат, 1990. 352 с.
5. Виленский Т.В., Хзмалян Д.В. Динамика горения пылевидного топлива. М.: Энергия, 1978. 248 с.
6. Тепловой расчет котельных агрегатов (нормативный метод)/ Н.В.Кузнецов, В.В.Митор, И.Е.Дубовский, Э.С.Карасина. М.: Энергия, 1973. 295 с.
7. Белосельский Б.С., Соколов В.К. Энергетическое топливо. М.: Энергия, 1980. 168 с.
8. Бабий В.И., Куваев Ю.Ф. Горение угольной пыли и расчет пылеугольного факела. М.: Энергоатомиздат, 1986. 208 с.