ОПРЕДЕЛЕНИЕ ФОРМУЛЫВЕЩЕСТВА ПО СОСТАВУ
Повторение формул:
Алканы
CnH2n+2
Алкены
CnH2n
Алкины
CnH2n-2
Алкадиены
CnH2n-2
Гомологи бензола
CnH2n-6
Предельные одноатомные спирты
CnH2n+2O или СnH2n+1OH
Многоатомные спирты
CnH2n+2Ox
Предельные альдегиды
CnH2nO или СnH2n+1COH
Кетоны
CnH2nO
Фенолы
CnH2n-6O
Предельные карбоновые кислоты
CnH2nO2 или СnH2n+1СООН
Сложные эфиры
CnH2nO2
Амины
CnH2n+3N
Аминокислоты
CnH2n+1NO2
II этап: «Обработка информации по данной проблеме». Рассмотрим несколько задач на вывод формулы органического соединения
Пример
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
1.Пусть масса вещества равна 100г.
Тогда масса С будет равна 84,21г, а масса Н — 15,79 г.
2. Найдём количество вещества каждого атома:
n(C) = m / М = 84,21 /12 = 7,0175 моль,
n(H) = 15,79 / 1 = 15,79 моль.
3. Определяем мольное соотношение атомов С и Н:
С: Н = 7,0175: 15,79 (сократим оба числа на меньшее) = 1: 2,25 (домножим на 4) = 4: 9.
Таким образом, простейшая формула — С4Н9.
4. По относительной плотности рассчитаем молярную массу:
М = D(возд.) * 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы. Значит, истинная формула — C8H18 Ответ: C8H18
Пример
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Общая формула алкина СnН2n-2.
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность р — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4л такого газа:
М = (плотность р) * (молярный объём Vm) = 2,41 г/л * 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 n — 2 = 54, n = 4. Значит, алкин имеет формулу C4H6 Ответ: C4H6
Пример
Определить формулу предельного альдегида, если известно, что 3*1022 молекул этого альдегида весят 4,3г.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02*1023 (молекул). Значит, можно найти количество вещества альдегида: n= N / Na = 3*1022 / 6,02*1023 = 0,05 моль, и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Общая формула предельного альдегида СnН2nО, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 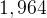 г/л. Массовая доля углерода в нем равна
г/л. Массовая доля углерода в нем равна 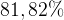 . Выведите молекулярную формулу этого углеводорода.
. Выведите молекулярную формулу этого углеводорода.
1–2. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 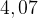 . Выведите молекулярную формулу карбоновой кислоты.
. Выведите молекулярную формулу карбоновой кислоты.
1–3. 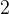 л алкадиена при н.у. имеет массу, равную
л алкадиена при н.у. имеет массу, равную 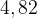 г. Выведите молекулярную формулу алкадиена.
г. Выведите молекулярную формулу алкадиена.
Определить формулу алкадиена, если 3,4г его могут обесцветить 80 г 2%-го раствора брома.
1. Общая формула алкадиенов — СnН2n-2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnН2n-2 + 2Вr2 —► СnН2n-2 Вr4
2. Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Вr2) = mраствора * ω = 80 * 0,02 = 1,6г
n(Br2) = m/ M = 1,6/160 = 0,01 моль.
3. Так как количество брома, вступившего в реакцию, в 2 раза больше, чем количество алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
Мдиена = m / n = 3,4 / 0,05 = 68 г/моль.
4. Находим формулу алкадиена по его общей формуле, выражая молярную массу через n:
14n — 2 = 68
n = 5. Это пентадиен C5H8. Ответ: C5H8.
Пример
При взаимодействии 0,74г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112мл пропена (н. у). Что это за спирт?
1. Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
2. Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2СnН2n+1 ОН + 2Na —► 2CnH2n+1ONa + Н2
С3Н6 + Н2 —► С3Н8
3. Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
n(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => v(H2) = 0,005 моль,
n(спирта) = 0,005 * 2 = 0,01 моль.
Находим молярную массу спирта:
Мспирта = m / n = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74 14n = 56 n = 4.
Спирт — бутанол С4Н7ОН. Ответ: С4Н7ОН.
Пример
Определить формулу сложного эфира, при гидролизе 2,64г которого выделяется 1,38г спирта и 1,8 г одноосновной карбоновой кислоты.
1. Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
СnН2n+1 COOCmH2m+1
Соответственно, спирт будет иметь формулу
СmН2m+1ОН, а кислота
СnН2n+1 COOH
Уравнение гидролиза сложного эфира:
СnН2n+1 COOCmH2m+1 + Н2О —► СmН2m+1ОН + СnН2n+1 COOH
2. Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
mH2O = (масса кислоты) + (масса спирта) — (масса эфира) = 1,38 + 1,8 — 2,64 = 0,54г
nH2O = m / М = 0,54 /18 = 0,03 моль
Соответственно, количества веществ кислоты и спирта тоже равны 0,03моль.
Можно найти их молярные массы:
Мкислоты = m / n = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.
Получим два уравнения, из которых найдём тип:
МСnН2n+1 COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MСmН2m+1ОН = 14m + 18 = 46, m = 2 — этанол.
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: СН3СООС2Н5-этиловый эфир уксусной кислоты.
3–1. Определить формулу алкена, если известно, что он 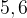 г его при присоединении воды образуют
г его при присоединении воды образуют 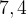 г спирта.
г спирта.
3–2. При взаимодействии предельного двухатомного спирта массой 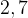 г с избытком калия выделилось
г с избытком калия выделилось 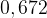 л водорода. Определить формулу спирта.
л водорода. Определить формулу спирта.
3–3. При окислении предельного одноатомного спирта оксидом меди (II) получили 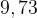 г альдегида,
г альдегида, 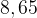 г меди и воду. Определить молекулярную формулу этого спирта.
г меди и воду. Определить молекулярную формулу этого спирта.
3-4.Некоторое количество алкена Х при взаимодействии с избытком хлора образует 11,3 г дихлорида, а при реакции с избытком брома - 20,2 г дибромида. Определите молекулярную формулу Х.